Utilisation des données du dossier de santé électronique pour la recherche en santé - défis en matière de gouvernance et approches possibles
Cette page Web a été archivée dans le Web
L’information dont il est indiqué qu’elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n’est pas assujettie aux normes Web du gouvernement du Canada et elle n’a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Donald J. Willison, D.Sc.
Professeur agrégé, département d'épidémiologie clinique et de biostatistique, Université McMaster
Ce rapport a été commandé par le Commissariat à la protection de la vie privée du Canada
Mars 2009
Avis de non-responsabilité: Les opinions exprimées dans ce rapport sont celles de l’auteur. Elles ne reflètent pas nécessairement celles du Commissariat à la protection de la vie privée du Canada.
Remerciements
Le présent document a été préparé à la demande du Commissariat à la protection de la vie privée du Canada. Les opinions et points de vue contenus dans ce document n'engagent que leur auteur et ne reflètent pas nécessairement ceux du Commissariat à la protection de la vie privée du Canada ni ceux du gouvernement du Canada.
J'aimerais remercier Patricia Kosseim, Philippa Lawson et Ed Brown pour leurs précieux commentaires concernant une ébauche précédente de ce document. De nombreuses discussions avec Elaine Gibson et Kim McGrail m'ont aussi apporté beaucoup et m'ont permis de mettre d'autres idées sur papier dans un document actuellement en préparation. Merci aussi à Sue Johnston et à Jennifer Ranford pour leurs commentaires.
Sommaire
Les chercheurs du milieu universitaire envisagent la possibilité que le dossier de santé électronique (DSE) commun interopérable offre des capacités améliorées pour effectuer toutes sortes de recherches dans le domaine de la santé. Par ailleurs, l'accès aux données d'un DSE qui serait interopérable à l'échelle de tout le système pose un certain nombre de défis sur lesquels on ne s'est toujours pas penché. Inforoute Santé du Canada reconnaît qu'il y aura des demandes d'utilisation secondaire du DSE à des fins de recherche et que cela soulève d'importantes questions. Entre autres, dans quelle mesure et comment les personnes devraient‑elles être informées de ces utilisations, quel niveau d'anonymat est nécessaire avant que l'information puisse être utilisée de manière éthique à des fins de recherche sans que l'obtention d'un consentement ne soit nécessaire, et est-ce que le DSE devrait indiquer le consentement d'un patient à ce que l'on communique avec lui à des fins de recherche. Ce document traite des défis en matière de gouvernance de l'utilisation des renseignements sur la santé à des fins de recherche ainsi que des approches possibles pour faire face à ces défis dans le contexte d'un DSE commun interopérable.
Le présent document compte trois parties. La première partie est, dans une large mesure, une sorte d'introduction pour les lecteurs qui ne sont pas familiers avec les types d'utilisation potentielle des renseignements sur la santé en recherche, provenant soit du DSE ou de nombreuses autres sources potentielles. La plupart des utilisations en recherche dont traite ce document reposent sur des observations : recherche en matière d'innocuité et d'efficacité, santé publique, santé et sécurité au travail, recherche sur l'amélioration de la qualité, recherche sur les services et les politiques de santé, santé de la population et bioinformatique translationnelle. Les lecteurs qui connaissent bien ces sujets peuvent passer immédiatement à la deuxième partie.
La deuxième partie énumère un certain nombre de défis interreliés en matière de gouvernance de l'utilisation des renseignements sur la santé à des fins de recherche, de manière générale, et certains nouveaux défis dans le contexte d'un DSE commun interopérable, y compris :
- La richesse des données interreliées à l'échelle individuelle nécessaires à la plupart des recherches rend presque impossible la tâche de dépersonnaliser ces données pour qu'elles deviennent totalement anonymes.
- Les limites floues entre la recherche et un certain nombre d'utilisations secondaires des données qui créent d'importantes disparités en matière de surveillance éthique (y compris la protection de la vie privée) entre la recherche et ces autres utilisations secondaires.
- L'inquiétude grandissante à savoir que les normes éthiques actuelles concernant le consentement à l'utilisation des renseignements personnels sur la santé à des fins de recherche et que le processus actuel de consentement en deux étapes entraînent des biais considérables dans les résultats de recherche ainsi que des coûts supplémentaires importants.
- Le changement observé dans la façon de mener des recherches. De plus en plus, les équipes de chercheurs créent des dépôts de données (registres) et des biobanques qui servent de plateformes pour une vaste gamme de recherches futures qui remettent en cause les principes relatifs à l'équité dans le traitement de l'information concernant les limites de la collecte, de l'utilisation et de la conservation des données. Actuellement, l'existence de ces registres et de ces biobanques n'est pas documentée de manière systématique.
- Le manque de concordance entre les modèles de consentement conventionnels pour la recherche et la mise en place de registres et de biobanques de recherche qui serviront de plateformes pour une vaste gamme d'utilisations futures en recherche.
- L'absence de mécanismes efficaces pour connaître les choix en matière de consentement concernant la vaste gamme d'utilisations potentielles en recherche des renseignements personnels sur la santé. Le temps et les coûts connexes peuvent justifier l'impossibilité pratique d'obtenir un consentement dans le contexte actuel. Toutefois, les progrès réalisés concernant le DSE interopérable, notamment quant à l'inclusion d'un portail pour les patients dans leurs dossiers de santé, offrent des solutions potentielles.
- Le recoupement des compétences pour la surveillance de l'utilisation des renseignements sur la santé à des fins de recherche qui pourrait mener à un manque de leadership en matière de gouvernance.
On trouve un résumé de ces défis, ainsi que des recommandations connexes, aux tableaux 1 et 2 suivant ce sommaire.
Les défis dont traite la deuxième partie exigent une remise en question fondamentale de la manière dont les renseignements sont utilisés dans la recherche ainsi que du rôle de la recherche en matière de soins cliniques, de santé publique et d'amélioration de la qualité. En lien avec ce défi, la troisième partie décrit à quoi pourrait ressembler un système de gestion de l'information cohérent. La partie 3.1 suggère la dissolution des limites artificielles entre la recherche et l'amélioration de la qualité, la planification des systèmes, la santé publique et les autres utilisations secondaires dont on se soucie peu du point de vue éthique. Elle présente aussi une approche proportionnelle en matière d'examen éthique de toutes les utilisations secondaires en fonction du niveau de risque pour les personnes dont on utilise les renseignements personnels. De plus, elle propose la reconceptualisation des utilisations principales des renseignements sur la santé afin d'inclure la gestion de la santé des personnes et des populations, en plus de la gestion du système de soins de santé, y compris la recherche connexe. La question du degré de contrôle que les personnes devraient avoir sur l'utilisation de leurs renseignements à des fins de recherche se pose toujours.
Dans la partie 3.2, on indique que les nouvelles approches relatives à l'utilisation à des fins de recherche des renseignements personnels contenus dans les dépôts à long terme de données de recherche nécessitent une approche élargie en matière de consentement et une reconnaissance que les différentes utilisations peuvent être liées à différents choix par défaut en matière de consentement. On propose des manières d'obtenir les choix en matière de consentement et de mieux les documenter ainsi que de simplifier le processus de choix pour empêcher la multiplication de décisions. L'une des approches envisagées, soit l'utilisation d'un portail pour le patient dans son dossier de santé, est particulièrement intéressante. Elle permettrait aux personnes de clairement documenter et faire part de leurs choix et de demeurer informés quant à l'utilisation de leurs renseignements personnels. On suggère aussi d'élargir les options de consentement au-delà du plein consentement ou de l'exemption du consentement habituels. Entre autres, on propose d'assigner différents choix par défaut en matière de consentement à différents types de recherche, en permettant (dans la plupart des cas) aux personnes de modifier ce choix. Ces choix par défaut devront être déterminés par consensus au terme d'un processus impliquant des chercheurs, des éthiciens, des organismes de réglementation et le public.
Afin de maintenir la confiance du public à l'égard de l'utilisation des renseignements personnels sur la santé, l'accès aux données pour la recherche devra être rigoureusement protégé. Il faudra décider qui pourra mettre en place les dépôts de données de recherche et dans quelles conditions. La partie 3.3 donne un aperçu des différentes options concernant le contrôle de l'accès et de la communication et la gouvernance de l'examen des projets de recherche individuels, de la mise en œuvre de dépôts de données de recherche et des pratiques d'utilisation des renseignements des institutions.
Il pourrait être utile de rassembler des études de cas représentant les principaux types de recherche par observation pour améliorer la cohérence dans le processus de prise de décisions des différents comités d'éthique de la recherche concernant les conditions à respecter par les chercheurs pour l'utilisation des renseignements sur la santé. Ces études devraient comprendre assez d'éléments et de commentaires analytiques pour permettre le repérage des facteurs importants qui influent sur les décisions quant au rôle du consentement, aux mesures de protection nécessaires et aux limites à l'accès et à la communication. Dans le cas de la recherche utilisant le DSE commun interopérable et des échantillons biologiques, on devra songer à la mise en place d'organismes d'examen spéciaux centralisés qui auraient la capacité de réviser les protocoles de recherche comprenant l'accès aux données du DSE et l'utilisation d'échantillons biologiques.
Le DSE interopérable pourrait rendre beaucoup plus facile la prolifération des bases de données. Cette partie suggère de gérer la prolifération au moyen de règlements nécessitant l'autorisation et l'enregistrement de tous les dépôts de données de recherche, de toutes les bases de données ou biobanques, en fonction de lignes directrices strictes.
Vu le manque actuel de leadership dans la gouvernance de la recherche à l'échelle de tout le système, les commissaires et ombudsmans à la protection de la vie privée fédérale et provinciaux devraient décider s'ils souhaitent jouer un rôle de chef de file à cet égard. Dans l'affirmative, des mesures devront être prises, en collaboration avec d'autres superviseurs potentiels de l'utilisation des renseignements sur la santé à des fins de recherche. Peu importe quel organisme assumera la responsabilité de cette fonction, l'une des approches envisagées est d'élaborer une structure de reddition de comptes pour que les institutions répertorient :
- les bases de données et les biobanques au sein de leur organisation;
- les études de recherche provenant des bases de données;
- les communications de données à d'autres institutions.
Les dépôts de données de recherche deviendront de puissants outils analytiques. Une fois leur mise en œuvre achevée, des mécanismes efficaces devront être élaborés pour que les utilisations possibles demeurent limitées aux objectifs de recherche de départ.
En terminant, la partie 3.4 traite des manières dont les parties concernées, notamment le public, pourraient participer à ce processus. On pourrait d'abord procéder à des consultations pour obtenir des commentaires sur l'acceptabilité des modèles et des conditions proposés en matière d'utilisations en recherche. On devra également s'entendre sur le volet éducatif, soit la sensibilisation du public à l'égard des diverses utilisations de leurs renseignements sur la santé au-delà des soins directs au patient, et des choix et des mécanismes pouvant leur permettre de contrôler l'utilisation de ces renseignements. De plus, il faudra sérieusement envisager une participation concrète et significative du public dans le processus de gouvernance en cours d'élaboration. Cela aiderait à aborder des questions comme la commercialisation des résultats de recherche.
En conclusion, ce document indique que les recherches observationnelles en santé et la protection de la vie privée sont d'intérêt public. Des divergences existent entre ces deux domaines mais l'on suggère des moyens de les faire coexister sans heurt.
Des changements marginaux ne sont pas suffisants. On devra rapidement se pencher sur la question de la gouvernance et des infrastructures pour éviter que le processus actuel ne mène à d'autres modifications ponctuelles insuffisantes et inefficaces à la gouvernance au détriment de la recherche, plutôt qu'à la mise en œuvre d'une solution globale.
| Partie | Recommandations | Principe relatif à l'équité dans le traitement de l'information pertinent* | |||||
|---|---|---|---|---|---|---|---|
| Détermination des fins | Consentement | Limitation de la collecte | Limitation de l'utilisation de la comm. et de la conservation | Mesures de sécurité et gouvernance | |||
| défis généraux | |||||||
1. La plupart des recherches en santé nécessitent des données interreliées à l'échelle individuelle. Les lois sur la protection des renseignements personnels régissent l'utilisation des renseignements personnels, c.-à-d. les renseignements qui permettent d'identifier une personne directement ou indirectement, par des moyens raisonnablement prévisibles. Les chercheurs dans le domaine de la santé ont généralement besoin de données interreliées à l'échelle individuelle pour leurs analyses. Toutefois, dans la plupart des cas, l'identité de la personne n'a aucune incidence sur les analyses. Même si les identifiants directs (nom, adresse, numéro d'assurance sociale, etc.) sont retirés, les renseignements qui demeurent sont assez riches pour permettre l'identification indirecte de la personne et doivent être gérés comme s'ils étaient des identifiants directs (renseignements personnels). Ces éléments de données particulièrement « à risque » pour identifier la personne suscitent également l'intérêt des chercheurs. Par exemple :
|
2.1 | 9 à 11 | |||||
2. Limites floues. Les limites entre la recherche et un certain nombre d'utilisations secondaires reconnues des données sont floues. Par exemple :
Il y a aussi un flou grandissant autour de la recherche et des soins cliniques, notamment dans les domaines de la génomique et de l'évaluation après-commercialisation de médicaments et de dispositifs. |
2.2 | 1 à 3 | |||||
| 3. Nature variable de la recherche. De plus en plus, les projets de recherche à un seul objectif avec un nombre limité de chercheurs ouvrent la porte à la création de dépôts (registres) de données et de biobanques qui serviront de plateformes pour une vaste gamme d'utilisations futures en recherche pour de plus grandes équipes de chercheurs. Puisqu'il est impossible de prévoir toutes les questions de recherche au moment de l'élaboration du dépôt de données de recherche, on ne peut respecter les principes relatifs à l'équité dans le traitement de l'information concernant les limites de la collecte de données. En gros, toutes les données dans le dossier de santé pourraient servir à de futures recherches. Puisqu'il y aura un élargissement des utilisations prévues des données, il faudra aussi interpréter plus librement les principes relatifs à l'équité dans le traitement de l'information qui limitent l'utilisation et la conservation des données. |
2.3 | 4 à 7, 14 | √ | √ | |||
| défis relatifs au consentement | |||||||
| 4. Manque de concordance entre les modèles de consentement actuels et la recherche fondée sur l'observation. Les modèles de consentement traditionnels pour la recherche ne concordent pas avec l'utilisation de grands ensembles de données dans le contexte de l'épidémiologie. Les modèles de consentement actuels tendent à s'articuler autour des exigences relatives aux essais cliniques. L'approche dichotomique du plein consentement à un projet particulier ou de l'exemption du consentement n'est pas suffisante pour couvrir toute la gamme de possibilités de consentement dans le contexte de l'utilisation des données fondée sur l'observation dans diverses recherches. | 2.4.3 | 4, 5 | √ | ||||
| 5. Absence de mécanismes efficaces pour connaître les choix en matière de consentement eu égard à la vaste gamme d'utilisations potentielles en recherche des renseignements personnels sur la santé. En conséquence, le temps et les coûts connexes serviront d'arguments importants pour invoquer l'impossibilité pratique d'obtenir le consentement. | 2.4.3 | 6 à 8, 17 | √ | ||||
6. Répercussion sur la recherche des exigences actuelles en matière de consentement. On s'inquiète de plus en plus du fait que les normes éthiques actuelles relatives au consentement à l'utilisation des renseignements personnels sur la santé ont des répercussions négatives sur la recherche, car elles introduisent des biais de sélection et augmentent les coûts liés à la recherche. Cela s'applique :
|
2.4.2 | 7 | √ | ||||
| 7. Clauses « coffre-fort ». Il est impossible d'établir dans quelle mesure les clauses « coffre-fort » s'appliquent à l'utilisation en recherche de données anonymes, lorsqu'il n'y aura pas de tentative de communication avec le patient. | 2.4.5 | 6 à 8 | √ | ||||
| 8. Commercialisation de la recherche. La tendance vers la commercialisation des résultats de recherche crée des tensions puisque des recherches démontrent que les personnes souhaitent avoir un meilleur contrôle de l'utilisation de leurs renseignements personnels dans un contexte commercial. | 2.5.3 | 6 à 8 | √ | ||||
| défis relatifs à la limitation de l'utilisation à la communication et à la conservation | |||||||
| 9. Initiatives pour améliorer l'accès aux données de recherche. Des initiatives de recherche internationales par des organismes qui subventionnent la recherche d'intérêt public afin de rendre les données brutes plus facilement accessibles à d'autres chercheurs existent et entrent en conflit avec le principe relatif à l'équité dans le traitement de l'information qui limite la communication des données. Ces initiatives sont attribuables en grande partie au désir d'une meilleure administration des ressources en mettant davantage à profit les investissements effectués dans la collecte initiale. | 2.5.1 | 14 | √ | ||||
| 10. Conservation des données. Les chercheurs hésitent à détruire des données car il serait difficile et coûteux d'avoir à rebâtir les ensembles de données pour une nouvelle analyse des données et des historiques d'expertise dans l'éventualité où les résultats de recherche seraient contestés. | 2.5.2 | 14 | √ | ||||
| 11. Perte potentielle de données brutes pour la recherche. Le principe relatif à l'équité dans le traitement de l'information qui limite la conservation des données peut entraîner la perte de données importantes qui documentent l'exposition à des risques pour la santé s'il y a une période de latence, se mesurant en décennies, avant qu'une maladie spécifique ne se manifeste. | 2.7 | - | √ | ||||
| défis relatifs à la Gouvernance | |||||||
| 12. L'existence des dépôts de données et des biobanques n'est pas documentée de manière systématique. Il n'y a pas non plus de critères communs pour déterminer qui peut créer et gérer ces dépôts de données de recherche et dans quelles conditions. Les grandes institutions de recherche ont des normes rigoureuses quant à la gestion sécurisée des données en leur possession, mais les plus petits groupes n'accordent pas tous la même importance à ces questions. | 2.6.2 | 13, 14 | √ | ||||
| 13. Écarts dans les décisions des Comité d'éthique de la recherche (CER). On trouve des écarts considérables dans les décisions des CER relativement aux recherches qui peuvent être exemptées de l'obligation d'obtenir un consentement. De plus, il n'est pas clair que les différences entre les décisions de divers CER pour un même protocole sont justifiables. | 2.4.1 | 11, 12 | √ | √ | |||
| 14. Chevauchement des juridictions dans la surveillance de l'utilisation des renseignements sur la santé à des fins de recherche. Risque de créer un manque de leadership en matière de gouvernance. | 2.6.3 | 15, 19 | √ | ||||
| 15. Nécessité de maintenir la confiance du public à l'égard de l'utilisation des renseignements personnels sur la santé à des fins de recherche. | 16 à 18 | ||||||
| 16. Pas de consensus entre les parties intéressées. L'un des défis constants provient du fait que les parties ayant un droit de parole concernant l'utilisation des renseignements personnels sur la santé sont nombreuses : les chercheurs, les éthiciens, les avocats, les médecins, les dépositaires de données, les gouvernements et les patients ainsi que les membres de leurs familles. Cela ralentit les progrès vers des changements significatifs, notamment si les interactions favorisent le durcissement des positions. | 16 | ||||||
| * Les principes relatifs à l'équité dans le traitement de l'information constituent un ensemble de lignes directrices pour la collecte, la gestion, le traitement et la protection des renseignements personnels. En 1981, les pays membres de l'Organisation de coopération et de développement économiques se sont entendus sur ces principes qui sont maintenant au cœur de la plupart des lois sur la protection des renseignements personnels dans le monde occidental. Au Canada, l'Association canadienne de normalisation a adapté les principes relatifs à l'équité dans le traitement de l'information dans son Code type sur la protection des renseignements personnels pour en former dix, à savoir la responsabilité, la détermination des fins de la collecte des renseignements, le consentement, la limitation de la collecte, la limitation de l'utilisation, de la communication et de la conservation, l'exactitude, les mesures de sécurité, la transparence, l'accès aux renseignements personnels, et la possibilité de porter plainte à l'égard du non‑respect des principes (Association canadienne de normalisation, 1996). Les principes relatifs à l'équité dans le traitement de l'information respectent en grande partie les bonnes pratiques en matière de recherche. Ce tableau illustre les cinq principes pour lesquels il existe des défis concernant les pratiques actuelles et changeantes en matière de recherche. | |||||||
| Partie | Défi | Planification | |||
|---|---|---|---|---|---|
| Court terme | Moyen terme | Long terme | |||
| Revoir le rôle de la recherche vis-à-vis d'autres utilisations secondaires des renseignements personnels sur la santé | |||||
|
3.1 | 2 | √ | ||
|
3.1 | 2 | √ | ||
|
3.1 | 2 | √ | ||
| Consentement | |||||
|
3.2.1 | 3, 4 | √ | ||
|
3.2.2 | 3, 4 | √ | ||
|
3.2.3 | 3 à 5 | √ | ||
|
3.2.3 | 5 à 8 | √ | ||
|
3.2.3 | 5, 7 | √ | ||
| Contexte souhaitable pour la recherche | |||||
|
3.3.1 | 1, 9 | √ | ||
|
3.3.1 | 1 | √ | ||
|
3.3.2 | 13 | √ | ||
|
3.3.2 | 13 | √ | ||
|
3.3.2 | 12 | √ | ||
|
3.3.2 | 3, 9, 10, 12 | √ | ||
|
3.3.2 | 14 | √ | ||
|
3.4 | 5, 15 | √ | ||
|
3.4 | 15 | √ | √ | |
|
3.4 | 14, 15 | √ | √ | |
1. Contexte
1.1 Contexte et objectif du présent document
Dans le domaine des soins de santé, la transformation des dossiers papier en dossiers électroniques est un processus relativement lent qui s'effectue de manière inégale. Depuis 2001, Inforoute Santé du Canada a entrepris la création d'un dossier de santé électronique (DSE) interopérable et commun à tout le pays. Si Inforoute admet qu'il y aura des demandes d'utilisation secondaire des DSE à des fins de recherche, l'organisme a adopté une approche par étapes pour l'architecture de conception et il voit actuellement l'utilisation secondaire à des fins de recherche comme n'étant pas de son ressort (Anonyme, 2007b).
De façon générale, l'utilisation secondaire des renseignements sur la santé à des fins de recherche intéresse vivement le Commissariat à la protection de la vie privée du Canada. La mise en place d'un DSE pancanadien soulève des questions importantes telles que : les gens doivent-ils être informés de ces utilisations et comment les informer? Dans quelles circonstances le consentement est-il nécessaire et quelles sont celles où il ne serait pas nécessaire de l'obtenir? Comment consigner dans le DSE la volonté d'une personne de participer à la recherche? Quelle sera la gouvernance nécessaire pour l'utilisation de renseignements provenant des DSE à des fins de recherche? Il vaut mieux examiner ces questions et y répondre avant que l'utilisation de ces renseignements commence. Voilà l'objectif du présent document.
Le présent rapport décrit l'utilisation actuelle des renseignements personnels sur la santé provenant des DSE à des fins de recherche ainsi que l'utilisation qui est anticipée; les enjeux et les défis relatifs à la protection de la vie privée à considérer étant donné que les renseignements provenant des DSE sont consultés à des fins de recherche; et enfin, les approches possibles pour tenir compte de ces enjeux et de ces défis. Ce rapport cible la recherche observationnelle qui ne comporte aucune intervention active. De façon générale, deux motifs poussent les chercheurs à consulter les renseignements dans un dossier de santé : 1) l'extraction de données du dossier afin de possiblement lier ces données à des dossiers d'autres sources, sans aucun intérêt pour l'identification de la personne ni intention d'entrer en communication directe avec elle; 2) la prise de contact avec des patients, par exemple pour les inviter à participer à une étude qui nécessite une collecte directe de données auprès du patient. Dans ce cas, les chercheurs demandent généralement que certains renseignements du dossier de santé soient recueillis afin de cibler leurs efforts de recrutement. Les données peuvent être recueillies par une enquête ou un questionnaire. De plus, des mesures physiques peuvent être prises, comme celle de la tension artérielle, et des échantillons de sang ou d'urine peuvent être pris pour des analyses en laboratoire.
Ce rapport est divisé en trois parties. La première partie donne de l'information sur le contexte; elle est destinée au lecteur qui n'est pas familier avec les différents types de recherche sur la santé pouvant utiliser des renseignements provenant de dossiers de santé. Même si l'accent n'est pas mis sur les essais cliniques, ils sont brièvement décrits, car ils nécessitent aussi la consultation des renseignements sur la santé afin de trouver des participants potentiels. Ils procurent en outre un point de référence pour certaines méthodes de recherche observationnelle, comme la pharmacovigilance. La deuxième partie décrit plusieurs des défis éthiques interreliés qui dépassent parfois la stricte considération de la protection des renseignements personnels, mais qui sont liés à des préoccupations concernant la protection de la vie privée. Enfin, la troisième partie présente des approches pour relever les défis.
Les thèmes qui ressortent tout au long de ce rapport sont :
- les limites floues entre la recherche et la santé publique, l'amélioration de la qualité et même les soins cliniques;
- les défis des méthodes courantes de consentement, y compris
- la satisfaction des exigences relatives à la communication pour la recherche contemporaine observationnelle;
- les mécanismes appuyant le choix du patient à l'égard de l'utilisation de ses renseignements personnels sur la santé à des fins de recherche;
- les infrastructures physiques, les ressources humaines et les mécanismes de gouvernance qui doivent être en place pour gérer de façon sécurisée l'utilisation des renseignements personnels sur la santé à des fins de recherche.
1.2 Recherches sur la santé utilisant des renseignements tirés de DSE
Les sources de données existantes sont utilisées depuis longtemps pour répondre aux questions des recherches cliniques et épidémiologiques d'une façon rapide et efficace. Les études qui auraient demandé des années voire des décennies si elles avaient été effectuées par une collecte prospective de données se réalisent maintenant en quelques mois. Les chercheurs espèrent que l'arrivée du DSE commun interopérable augmentera davantage la rapidité et le rendement de la recherche et qu'elle permettra de répondre à un éventail beaucoup plus large de questions relatives à la santé.
Actuellement, la plupart des types de recherche décrits dans cette partie utilisent des renseignements personnels provenant de diverses sources, y compris des dossiers de santé classiques sur papier, des registresNote de bas de page 1 ainsi que des bases de données administratives qui sont surtout utilisées pour le traitement des demandes. Par ailleurs, les chercheurs en santé peuvent avoir accès à des renseignements non médicaux qui sont déterminants pour la santé, comme le niveau de scolarité et le revenu. Cette partie décrit les types de recherche en santé qui utilisent des renseignements personnels et, s'il y a lieu, la manière dont ces recherches peuvent être modifiées par l'utilisation du DSE interopérable.
1.2.1 Les essais cliniques
Les essais cliniques (aussi appelés essais cliniques aléatoires et essais cliniques à répartition aléatoire) sont des études d'interventions qui visent à démontrer l'efficacité potentielleNote de bas de page 2 de thérapies, de procédures ou de dispositifs précis dans une population très précise de patients. Les principales utilisations secondaires des dossiers de santé existants visent à établir les établissements de santé qui ont un assez grand volume de patients intéressants pour servir de sites de recrutement, et à trouver des participants potentiels qui pourraient être contactés en vue de participer à des essais cliniques.
Si l'état de santé d'intérêt est une maladie chronique, des participants potentiels à une recherche peuvent être trouvés grâce à un examen des dossiers médicaux. Lorsqu'un système de dossiers papier est utilisé, les dossiers sont d'abord triés à partir d'un bassin de participants potentiels substantiellement plus grand que la liste finale des patients admissibles. Puis, il faut qu'une personne passe en revue plusieurs parties des dossiers de ce plus grand bassin pour déterminer les patients qui pourront faire partie de l'essai clinique. La personne qui fait ce travail est souvent un adjoint de recherche. Il y a eu un débat dans les cercles bioéthiques concernant les personnes qui devraient être autorisées à parcourir les dossiers de santé pour trouver des participants potentiels à une recherche, et la manière dont ces derniers devraient être contactés pour participer à la recherche. De façon générale, il serait souhaitable que le processus soit effectué par une personne qui aurait normalement accès à ces renseignements dans un cadre thérapeutique ou administratif. Étant donné les effectifs limités, il peut y avoir des exceptions. Un système de dossiers de santé électroniques convenablement conçu porterait moins atteinte à la vie privée dans la mesure où il réduirait le nombre de dossiers de patients non admissibles qui étaient initialement sélectionnés manuellement par une personne en dehors du cercle de soins, et où il procurerait une méthode automatisée de sélection pour un ou plusieurs critères diagnostiquesNote de bas de page 3.
1.2.2 Les études sur l'innocuité et l'efficacité
S'ils sont « la » méthode de référence pour évaluer l'efficacité potentielle de nouveaux traitements, les essais cliniques ont des inconvénients pour la mesure de l'innocuité et de l'efficacité réelle de nouveaux traitements, notamment :
- la taille des échantillons est habituellement trop petite pour déceler autre chose que les effets indésirables les plus courants du traitement -- dans certains cas, il faut attendre que le traitement soit utilisé sur des milliers de patients pour que les effets indésirables moins courants (ou moins distinctifs) soient discernés;
- si les essais cliniques fournissent de l'information sur l'efficacité potentielle d'un traitement dans des circonstances idéales, la plupart de ces essais ne donnent pas d'information adéquate sur l'efficacité réelle du traitement (c.‑à‑d. s'il fonctionne bien dans les conditions réelles où les patients ont des maladies concomitantes et où les patients ne se conforment pas parfaitement à la médication, en le comparant avec la pratique exemplaire actuelle par opposition au placebo).
Actuellement, une grande partie de l'information pour la surveillance des événements indésirables provient de rapports spontanés qui peuvent servir de « signalisateurs » afin d'alerter les chercheurs de la possibilité d'un événement indésirable précis associé à un traitement. Advenant un soupçon d'association entre l'exposition à un traitement en particulier et certains événements indésirables pour la santé, on procède souvent à un examen rétrospectif des données en combinant au moins deux dossiers administratifs ou cliniques. Par exemple, une association entre l'exposition aux benzodiazépinesNote de bas de page 4 et les fractures causées par des chutes chez des personnes âgées a été faite en comparant des fichiers de remboursement de médicaments et des résumés concernant des congés d'hôpitaux au moyen d'un identifiant commun aux patients (Monane et Avorn, 1996). Ces études qui établissent des liens entre les dossiers peuvent être longues et laborieuses.
Les chercheurs se tourneraient probablement vers le système de DSE commun interopérable comme source de données idéale pour de telles recherches étant donné que les fichiers cliniques permettront des analyses de plus grande fiabilité que celles effectuées à l'aide de fichiers administratifs. La consultation par les chercheurs d'un système de DSE interopérable pourrait aussi favoriser davantage d'études nécessitant le forage des données dans lesquelles des associations sont comparées à des expositions à différents traitements et à un large éventail d'effets sur la santé, sans l'établissement préalable d'une hypothèse causale d'un effet précis (formulation d'hypothèse).
Différentes approches systématiques pour la collecte de données de pharmacovigilance servant à évaluer l'innocuité, l'efficacité et le rendement sont envisagées dans un projet fédéral d'homologation progressiveNote de bas de page 5 des produits pharmaceutiques au Canada. À cet effet, une approche en vigueur aux États-Unis, la « protection avec élaboration de preuves » (Pearson, Miller et Emanuel, 2006) a suscité de l'intérêt au Canada. Selon cette approche, des patients qui souhaitent une thérapie commercialisée particulière doivent soit autoriser la surveillance continue de leurs renseignements personnels sur la santé, soit participer à un essai pragmatiqueNote de bas de page 6 afin de recevoir gratuitement le traitement. On ne sait pas si les personnes auront la possibilité de se retirer d'un tel plan de surveillance sans avoir à payer pour la thérapie. Avec un DSE interopérable, la collecte de données pourrait se faire en partie grâce au téléchargement périodique automatisé de données provenant de différents dépôts de données du DSE commun dans un site central destiné à la recherche. Cela pourrait également donner lieu à une collecte supplémentaire de données qui n'est pas coutumière en dehors d'un environnement de recherche. En outre, cette approche accentue la confusion entre la recherche elle‑même et l'obligation de passer en revue les nouveaux médicaments et dispositifs pour en cerner les événements indésirables dans le cadre d'un plan d'homologation progressive.
1.2.3 La santé publique et la santé et sécurité au travail
En santé publique, il faut une perspective large pour déterminer la santé des populations, une perspective qui comprend la chaîne alimentaire, les réserves d'eau et les polluants provenant de l'environnement. Pour ce faire, elle fait appel à un éventail de données beaucoup plus large que les simples renseignements sur la santé.
En santé publique, les renseignements sur la santé sont utilisés de deux manières principales :
- pour la surveillance de routine, notamment
- des maladies transmissibles (comme la grippe, les ITS ou le SARM);
- des maladies chroniques (comme le diabète);
- pour des analyses spéciales, par exemple
- des analyses d'événements indésirables associés à l'exposition à des produits toxiques pour l'environnement, comme ceux provenant de dépôts d'ordures, les produits chimiques en milieu de travail ou les lignes à haute tension;
- des analyses faisant le suivi d'épidémies de maladies d'origine alimentaire.
Pour certaines maladies transmissibles, la déclaration des cas est obligatoire. Il s'agit d'une forme de surveillance qui se concentre davantage sur la répartition géographique des événements, laquelle accentue le risque de repersonnalisation. Avec l'arrivée du DSE commun interopérable, la collecte de données destinée aux rapports de santé publique deviendra probablement automatisée. Dans de nombreux cas, la distinction entre la surveillance de routine en santé publique et la recherche en santé publique, qui utilisent les mêmes données, est floue.
Les analyses spéciales ont davantage de risques de se confondre avec les activités de recherche, car les méthodes d'étude utilisées sont pour ainsi dire identiques. En outre, il y a de fortes chances que le rapport soit publié dans une revue arbitrée. Les sources de données pour ces études dépendent du sujet de recherche et elles peuvent comprendre la collecte de données primaires au moyen d'enquêtes, la collecte de données dans des résumés concernant des congés d'hôpitaux ou l'examen de dossiers médicaux.
1.2.4 La santé de la population
Comme en santé publique, la recherche sur la santé de la population nécessite une vision beaucoup plus étendue des déterminants de la santé afin d'inclure des facteurs tels que le revenu, le niveau de scolarité, le logement et l'environnement. Ces études comprennent habituellement l'analyse de grands ensembles de données diversifiés qui combinent des renseignements sur l'utilisation des services de santé et des services sociaux, les dossiers scolaires, le revenu et des données sociospatiales. En raison de l'aspect complexe de l'organisation de ces données et des possibilités d'utilisation et d'utilisation abusive des données, des efforts sont entrepris pour constituer des centrales de données qui serviront de plateformes à différentes recherches. Les objectifs de ces enclaves de données sont d'offrir l'expertise sur l'association et l'interprétation des données ainsi que de hauts niveaux de protection des donnéesNote de bas de page 7.
1.2.5 La recherche visant l'amélioration de la qualité
Comme en santé publique, il est de plus en plus difficile de distinguer l'amélioration de la qualité de la recherche visant l'amélioration de la qualité. Les méthodes utilisées sont très similaires. La recherche visant l'amélioration de la qualité et l'amélioration de la qualité elle-même dépendent toutes deux grandement de l'étude rétrospective des dossiers médicaux, mais elles ont parfois aussi recours à des études prospectives pour recueillir davantage de données. La recherche visant l'amélioration de la qualité est très hétérogène, et l'utilisation des données provenant des DSE variera beaucoup. Les éléments communs comprennent la sélection d'un diagnostic, d'une intervention (médicament, chirurgie, dispositif) ou d'effets précis pour regrouper des cohortes de patients intéressants, et le test d'associations entre des interventions et des effets variés.
1.2.6 La recherche sur les services et les politiques en matière de santé
Le système de santé du Canada administré par les provinces a servi de laboratoire naturel pour l'examen de la répercussion des politiques en matière de santé sur la prestation des soins de santé et sur la santé. L'utilisation des renseignements sur la santé pour cet examen suppose des comparaisons au fil du temps de politiques et d'effets dans une même province et particulièrement entre les provinces. Jusqu'à maintenant, les comparaisons entre les provinces ont été préparées ponctuellement, de façon générale en exportant des données d'un site à un autre. La recherche sur les services et les politiques en matière de santé est lourdement gênée par des difficultés de regroupement des données comparatives à l'échelle individuelle dans les provinces. Les difficultés sont d'ordre politique, juridique (différences entre les lois provinciales sur la protection des renseignements personnels) et définitionnel (absence de définitions standard ou de documentation sur les services ou interventions essentiellement identiques). Le DSE commun résoudrait certains des problèmes techniques d'accès aux données, mais des politiques et des procédures devront être élaborées afin de déterminer la manière d'effectuer des analyses comparatives, par exemple
- par la centralisation des données dans un entrepôt commun et par le peaufinement en vue de créer des ensembles communs de données;
- par des structures parallèles d'entrepôt de données, dans les provinces, permettant d'effectuer des analyses parallèles.
1.2.7 La bioinformatique translationnelle
La bioinformatique translationnelleNote de bas de page 8 est un domaine de recherche relativement nouveau qui tente de faire des associations entre des variations génétiques et la santé. Actuellement, la plupart des activités de recherche se concentrent sur la vérification d'hypothèses spécifiques concernant l'association entre des variantes de petits segments d'ADN (SNP) et des manifestations précises sur la santé (p. ex., l'obésité, l'hypertension ou la prédisposition à une forme particulière de cancer). Cependant, l'objectif est de faire des associations générales, positives et négatives, entre les variations du génome humain et une vaste gamme d'états de santé connus. En fin de compte, l'éventuel forage des données de centaines de milliers de personnes permettra à ce type de recherche d'effectuer la cartographie complète du génome entier et la liaison de cette information à celle provenant des DSE. Par sa nature, le forage des données ne vérifie pas d'hypothèse précise quant aux associations causales d'une expression génétique en particulier et d'un état de santé. Le forage détermine plutôt des associations qui pourraient être vérifiées dans le futur. Aucune question de recherche n'est donc formulée.
La cartographie de génomes entiers est pour l'instant impossible à grande échelle, principalement en raison de la capacité et des coûts. Le coût actuel de la cartographie d'un seul génome entier (environ trois milliards de paires de bases) se situe autour de 100 000 $. Le National Institutes of Health a fixé l'objectif de réduire le coût de la cartographie d'un génome entier à 1 000 $ d'ici 2014, pour qu'il soit possible de l'inclure dans les soins médicaux courants (Anonyme, 2008c). On prévoit que cela sera techniquement réalisable avant cette date (Shaffer, 2007).
En outre, de grands défis techniques sont associés à la collecte automatique de données provenant des DSE, car beaucoup de renseignements seront saisis sous forme de texte libre. Par conséquent, énormément de recherches sont effectuées pour concevoir des algorithmes qui permettront l'extraction des données cibles provenant de zones de texte libre et fourniront des marqueurs valides et fiables de la présence de maladies particulières (Meystre, Savova, Kipper‑Schuler et Hurdle, 2008). Des efforts sont également entrepris pour déterminer des façons de crypter les renseignements au dossier afin de les anonymiser (Adida et Kohane, 2006).
Actuellement, un petit nombre de sites aux États-Unis. effectuent des liens à grande échelle entre le génome et les DSE. La plupart de ces sites dépersonnalisent suffisamment les données pour se passer de l'obtention du consentement, requis en vertu de la réglementation des États-Unis, à l'utilisation des échantillons qui proviennent souvent de surplus de tissus prélevés lors de traitements. Toutefois, on a récemment démontré qu'il était possible de repersonnaliser ces données d'ADN séquencé qui sont considérées comme anonymes en vertu de la loi (Couzin, 2008; Malin et Sweeney, 2001; McGuire et Gibbs, 2006)Note de bas de page 9. L'incidence que cela aura sur le contexte canadien reste à voir, mais il s'agit d'un secteur qui nécessite une attention puisque dans plusieurs provinces du pays des efforts visent à mettre en route des initiatives en bioinformatique. Il est probable que des considérations éthiques relatives au consentement, à la reprise de contact et à la gouvernance des activités de recherche seront grandement influencées par le protocole d'accord international récent auquel ont participé de très éminents universitaires du Canada et des États-Unis dans les domaines bioéthique et juridique (Caulfield, McGuire, Cho, Buchanan, Burgess, Danilczyk et coll., 2008).
2. Enjeux et défis
2.1 La plupart des recherches en santé exigent des données à l'échelle individuelle qui peuvent être couplées à un dossier
Pour la majorité des recherches décrites dans la partie précédente, les chercheurs n'ont aucun intérêt pour l'identité réelle des personnesNote de bas de page 10. Toutefois, des données à l'échelle individuelle qui peuvent être couplées à un dossier sont nécessaires pour plusieurs raisons :
- Pour des analyses. Lors de l'étude du rapport entre une certaine exposition (à un médicament, à une procédure, à une politique) et un effet sur la santé, les données à l'échelle individuelle permettent aux chercheurs d'obtenir une évaluation encore plus précise du rapport entre l'exposition et l'effet, car ils peuvent « contrôler » d'autres facteurs qui pourraient avoir une incidence.
- Pour constater les conséquences inattendues des politiques. Les tentatives pour freiner les dépenses dans un portefeuille budgétaire (p. ex., produits pharmaceutiques) peuvent entraîner des hausses imprévues de l'utilisation d'autres portefeuilles (p. ex., visites chez le médecin, visites au service des urgences). Par conséquent, toute évaluation des politiques devrait se pencher sur les effets inattendus sur d'autres enveloppes budgétaires, un effet qu'on désigne souvent comme « changer le mal de place ». Pour tenir compte de cet effet, il est habituellement nécessaire de combiner des dossiers de différentes sources qui comprennent des déterminants non médicaux de la santé. Dans l'environnement actuel où les données ne sont pas intégrées, il faut un identifiant commun pour coupler les dossiers afin d'examiner les déterminants.
- Pour des études prospectives suivant des cohortes particulières de patients. Ces études nécessitent de temps à autre la mise à jour des dossiers. Un identifiant commun permet de le faire.
Dans la plupart des cas, des identifiants directs peuvent être facilement supprimés sans perturber la recherche, tant qu'il reste possible de coupler les dossiers de santé disparates, car l'identité des personnes n'est pas importante pour la recherche. Cependant, les données restantes sont souvent suffisamment riches en variables d'identification indirecte (dates de naissance, données géographiques, dates d'admission, congés, procédures spécifiques) pour les rendre repersonnalisables.
Un corpus imposant consigne les façons de réduire au minimum les risques de repersonnalisation grâce à des méthodes de contrôle de la communication statistique (Anonyme, 1994; El Emam, Jonker, Sams, Neri, Neisa, Gao et coll., 2007; Eurostat, 1996). Un grand nombre de méthodes sont plutôt techniques et exigent actuellement une expertise qui n'est pas très répandue. En fonction des questions posées dans le protocole de recherche, les décisions concernant la technique la plus pertinente à utiliser et les variables à masquer font en partie appel au jugement personnel. En somme, même les données sans identifiants directs devraient être considérées comme ayant un potentiel de repersonnalisation.
2.2 Les limites floues entre l'utilisation des renseignements à des fins de recherche et les autres utilisations secondaires, notamment l'utilisation à des fins de soins cliniques
Une référence est souvent faite aux utilisations primaire et secondaire des renseignements provenant des dossiers de santé. En général, l'utilisation primaire désigne l'utilisation destinée à la gestion des soins d'un seul patient. L'utilisation secondaire concerne tous les autres usages. Selon les principes relatifs à l'équité dans le traitement de l'informationNote de bas de page 11 qui constituent la base de presque toutes les lois sur la protection des données dans le monde occidental, toute utilisation secondaire des renseignements à des fins de recherche devrait faire l'objet d'un consentement, sauf si c'est irréaliste.
Dans les faits, nombre d'utilisations secondaires des renseignements provenant des dossiers de santé, comme l'amélioration de la qualité, la gestion des risques, l'amélioration des systèmes de santé, la prévention des infections et la santé publique, ont été autorisées sans la nécessité d'obtenir un consentement supplémentaire. On sait peu de choses des politiques des établissements de santé concernant l'utilisation secondaire des renseignements personnels sur la santé qu'ils détiennent, sauf qu'en matière d'utilisation secondaire, les patients n'ont généralement pas la possibilité de refuser.
Par contre, l'utilisation secondaire des mêmes renseignements personnels à des fins de recherche est traitée bien autrement. En général, cette utilisation n'est pas autorisée sans un consentement explicite, à moins qu'une exemption soit accordée par un comité d'éthique de la recherche. Toutefois, rappelons qu'il y a un recoupement considérable dans l'utilisation des données à des fins de recherche, d'amélioration de la qualité, de santé publique et de gestion des systèmes de santé. Du point de vue des politiques, il s'agit d'un défi important (Kosseim et Brady, 2008). Par exemple, si l'utilisation secondaire est considérée comme une « amélioration de la qualité », alors il existe une exemption à l'obtention du consentement des personnes et l'utilisation de l'information ne fera l'objet que de très peu de surveillance. Si l'utilisation est considérée comme de la « recherche », le consentement des personnes peut être exigé. De plus, un ou plusieurs comités d'éthique de la recherche et dépositaires de données examineront l'utilisation qui est faite des renseignements. En parallèle, les exigences en matière de consentement et le processus d'examen qui limitent la capacité de faire de la recherche fondée sur l'observation ainsi que de la recherche épidémiologique font l'objet d'une préoccupation grandissante.
La distinction entre la recherche et les soins cliniques commence aussi à être moins nette. Par exemple, l'évaluation continue après commercialisation de médicaments et de dispositifs par des essais pragmatiques et des programmes comme la protection avec élaboration de preuves a comme résultat que la recherche s'introduit dans la pratique clinique courante, estompant ainsi la relation de traitement entre le médecin et le patient (Fransen, van Marrewijk, Mujakovic, Muris, Laheij, Numans et coll., 2007; Maclure, Carleton et Schneeweiss, 2007; Miller et Pearson, 2008; Pearson, Miller et Emanuel, 2006).
En outre, dans les domaines de la génomique et de la bioinformatique translationnelle, certains chercheurs entrent déjà des renseignements génomiques dans les dossiers cliniques. Il est également attendu que, lorsque le coût du séquençage du génome humain complet chutera, ces renseignements seront couramment entrés dans les dossiers cliniques, même si la plupart de ces renseignements n'ont pas d'utilité clinique pour l'instantNote de bas de page 12. De plus, il y a dans la documentation des avis partagés sur la nécessité de révéler aux patients les résultats de la recherche génomique (ou de quelle manière le faire) (Clayton et Ross, 2006; Kohane, Mandl, Taylor, Holm, Nigrin et Kunkel, 2007; Miller, Giacomini, Ahern, Robert et de Laat, 2008; Wolf, Lawrenz, Nelson, Kahn, Cho, Clayton et coll., 2008). Cela accentue le flou dans la distinction entre la recherche et les soins cliniquesNote de bas de page 13. À l'avenir, il pourrait y avoir un haut degré d'amalgamation entre la recherche et les soins cliniques, notamment si la communication directe aux patients des résultats de recherche devient une pratique courante (Miller et coll., 2008).
2.3 La nature variable de la recherche observationnelle
Une grande part de la recherche observationnelle susmentionnée passe de la collecte de données sur une période donnée dans le cadre d'études précises à la constitution de bases de données (registres), de biobanques et de combinaisons de celles-ci qui serviront de plateformes pour un large éventail de recherches. Les registres ont été conçus au départ pour faciliter l'identification et l'étude de patients ayant des états de santé relativement rares ou ayant des traitements qui comportent des risques élevés d'effets indésirables. Au cours des dernières années, les registres se sont multipliés en réaction aux défis associés à la réalisation d'études observationnelles dans plusieurs sites. Il y a 20 ans, ces registres ne contenaient guère plus que des diagnostics et des coordonnées. Aujourd'hui, ils ont plutôt tendance à être très riches en données et ils réduisent au minimum le besoin de retourner consulter les dossiers cliniques. La taille des registres varie considérablement. Quelques registres sont fondés sur le consentement, certains fonctionnent au moyen d'avis et d'option de refus et d'autres n'offrent pas la possibilité de refuser le consentement.
Actuellement, aucune documentation systématique n'est faite des différents registres de recherche et biobanques qui existent dans les centres de recherches universitaires. De plus, en ce qui a trait à ces avoirs, les limites de l'obligation de rendre des comptes ne sont pas claires. Les comités d'éthique de la recherche (CER) sont généralement responsables de l'examen des propositions de recherche, mais il n'est pas clair si la surveillance continue des registres est du ressort des CER (Gibson, Willison, Brazil, Coughlin, Emerson, Fournier et coll., 2008).
Selon les principes relatifs à l'équité dans le traitement de l'information, un chercheur ne devrait recueillir que les renseignements qui lui sont nécessaires pour réaliser sa recherche. Lorsque l'objectif est d'élaborer une plateforme de recherche visant à répondre à des questions de recherche éventuelles et indéterminées, alors les principes ne sont plus respectés. Ce problème nécessite une solution à grande portée.
Le DSE commun interopérable n'éliminera probablement pas la nécessité des registres de recherche. En général, les données extraites des dossiers de santé doivent être nettoyées et réorganisées avant de pouvoir servir à la recherche (Tezeta, 2008). Aussi, les registres peuvent être augmentés de données recueillies précisément à des fins de recherche.
2.4 Les défis relatifs au consentement
Le consentement pose de nombreux défis pour la recherche observationnelle en santé qui utilise des données existantes. Dans cette partie, ces défis sont décrits selon des contextes d'utilisation des données existantes où il n'y a pas de contact avec le patient, où l'identité de la personne n'est pas importante et où le chercheur a besoin des coordonnées de la personne pour communiquer avec elle.
2.4.1 Les exemptions à la nécessité d'obtenir le consentement
Si des exemptions à la nécessité d'obtenir le consentement des personnes peuvent être accordées pour la communication de renseignements personnels sur la santé à un chercheur, l'Énoncé de politique des trois Conseils exige que le chercheur prouve au CER que les renseignements sur l'identité sont essentiels à la recherche, que des mesures de sécurité adéquates sont en place afin de protéger l'identité de la personne et que les personnes dont les données seront utilisées n'y ont pas d'objection. Par ailleurs, dans nombre de provinces, les lois exigent que le chercheur démontre qu'il est irréaliste d'obtenir le consentement. Certaines lois demandent d'évaluer l'intérêt public de la recherche. Enfin, dans la plupart des cas, la loi exige que la communication des renseignements soit faite à la condition que le chercheur n'essaie pas d'entrer en contact avec les personnes visées. Il y a une place considérable à l'interprétation quand il faut déterminer le caractère irréaliste de l'obtention du consentement. Afin de faciliter cette interprétation, le document sur les pratiques exemplaires en matière de protection de la vie privée dans la recherche en santé diffusé par les Instituts de recherche en santé du Canada (IRSC) précise que l'obtention du consentement peut être irréaliste quand il est difficile de contacter les personnes en raison :
- de la taille de la population sur laquelle porte la recherche;
- de la proportion des personnes qui ont probablement déménagé ou qui sont probablement décédées depuis la collecte des données initiales;
- de l'absence de lien existant ou continu entre les personnes et l'organisme.
Si, pour une de ces raisons, il y a risque d'introduire un biais important dans la recherche, ou si les ressources financières, matérielles, humaines, organisationnelles et les autres ressources additionnelles nécessaires imposent un fardeau tel que la recherche ne pourrait pas être entreprise, alors on considérera que des motifs raisonnables valident le caractère irréaliste de l'obtention du consentement (Instituts de recherche en santé du Canada, 2005).
Malgré ces précisions, on trouve des désaccords considérables entre les CER sur la nécessité d'obtenir le consentement pour la recherche lorsqu'il s'agit de l'examen rétrospectif des dossiers médicaux (Willison, Emerson, Szala-Meneok, Gibson, Schwartz, Weisbaum et coll., 2008a). Ces désaccords témoignent d'un plus grand défi ayant trait au manque de constance dans le processus d'examen éthique et, de façon générale, aux contradictions dans les décisions des CER (Sous-groupe sur les questions relatives aux procédures de l'EPTC (Groupe Pro), 2008).
2.4.2 L'incidence du consentement sur la validité de la recherche en santé
Rappelons qu'il y a de plus en plus de signes montrant que le biais de sélection est peut-être causé par la nécessité d'obtenir le consentement à l'utilisation des renseignements personnels à des fins de recherche en santé (Kho, Duffett, Willison, Cook et Browers, 2008). La nature et la direction des biais observés ne sont pas constantes, ce qui rend difficile la prévision de leur incidence. La variation dans la participation est une préoccupation particulière, car elle influe sur les conclusions tirées à propos des effets sur la santé. Par exemple, avec le Registre de l'AVC, les gens ayant subi les accidents vasculaires cérébraux (AVC) les plus graves, les AVC les moins graves ou des accidents ischémiques transitoires (AIT) sont les moins susceptibles de participer à l'étude. Dans le cas des AVC graves, soit que les personnes chargées de recruter étaient réticentes à communiquer avec les familles des patients, soit que ces derniers sont décédés avant qu'on ait pu communiquer avec eux. Dans le cas des AIT, nombre de patients ont reçu leur congé de l'hôpital avant que les personnes chargées de recruter puissent communiquer avec eux et plusieurs hôpitaux ont refusé qu'elles communiquent avec les patients après qu'ils ont quitté l'hôpital (Willison, Kapral, Peladeau, Richards, Fang et Silver, 2006).
2.4.3 Les limites des modèles de consentement existants dans le contexte des registres et des biobanques
Lorsque la nécessité du consentement a été déterminée pour la participation à un registre destiné à la recherche, il reste les défis liés à la satisfaction des exigences existantes en matière de consentement. Ces exigences élaborées pour les besoins des essais cliniques tiennent compte des faits suivants :
- il s'agit d'une étude unique avec des objectifs de recherche précis;
- il est possible de préciser à l'avance les éléments de données essentiels à analyser;
- les risques associés à la participation sont aisément quantifiables.
Comme il est décrit dans la partie 2.3, la nature de la recherche observationnelle passe des études courantes astreintes à des questions de recherche précises à la création de plateformes de recherche. On pousse ainsi les limites du processus de consentement habituel. Car il est notamment impossible de décrire toutes les utilisations possibles des renseignements, puisqu'un grand nombre des futures questions de recherche sont inconnues. Voilà qui soulève la question du niveau de détail requis pour satisfaire l'exigence d'un consentement réellement éclairé. Si trop peu d'information est fournie (p. ex., un consentement général pour « toute utilisation future »), alors on pourrait soutenir de façon justifiée que le consentement n'était pas valide. Si une description de toutes les utilisations imaginables était exigée, alors cette énumération pourrait bien masquer l'information clé qui éclairerait la personne sur son engagement, tout en étant probablement loin de constituer une information complète. Afin d'en savoir davantage à ce sujet, on peut consulter le travail récent de Kosseim et Brady (Kosseim et Brady, 2008).
Étant donné le grand nombre d'utilisations possibles des renseignements sur la santé à des fins de recherche, le débat récent s'est éloigné de l'approche dichotomique du consentement à un projet particulier ou de l'exemption de tout consentement vers un consentement échelonné (Caulfield, Upshur et Daar, 2003; Singleton et Wadsworth, 2006). Une recherche suggère que le consentement est influencé par le type de recherche, qui la mène, le type de renseignements qui seront consultés ou couplés ainsi que l'étendue de la portion commerciale de la recherche (Willison, Schwartz, Abelson, Charles, Swinton, Northrup et coll., 2007; Willison, Swinton, Schwartz, Abelson, Charles, Northrup et coll., 2008b). En général, les gens trouvent qu'un processus de consentement passif (avis contenant une option de refus ou utilisation sans avis préalable) est acceptable si l'utilisation concerne le « bien commun » comme l'amélioration de la qualité ou la santé publique, mais ils veulent un meilleur contrôle si la recherche concerne la commercialisation éventuelle de produits découlant de la recherche. Toutefois, la plupart des recherches ne peuvent pas être clairement catégorisées d'intérêt public ou commercial seulement.
Si on offre plusieurs options de consentement pour les différentes utilisations des renseignements sur la santé à des fins de recherche, il faut prendre soin d'éviter une lassitude à l'égard des décisions (Ram, 2008). Ce problème est surtout pertinent dans le contexte des registres et des biobanques et il ne fera que croître avec l'arrivée de la bioinformatique translationnelle et de la recherche sur le génome complet.
2.4.4 La prise de contact en vue d'une participation active à la recherche
Un des grands défis de la recherche en santé est l'identification de participants potentiels et la communication avec eux afin qu'ils participent à la recherche, que ce soit pour une étude fondée observationnelle ou pour un essai clinique. Aux États-Unis et au Royaume-Uni, un des objectifs explicites de la mise en place des DSE est d'aider à recruter des patients pour la recherche clinique (Anonyme, 2007a; Anonyme, 2008a; Westfall, Mold et Fagnan, 2007). Cette utilisation future des DSE ne fait pas encore partie des plans au Canada, mais il faut s'attendre à devoir en débattre.
Au Canada, la pratique actuelle exige un consentement en deux volets :
- Le patient est d'abord approché par une personne qui est raisonnablement autorisée à avoir accès aux renseignements sur son état de santé et qui n'a pas sur elle une influence indue. L'objet de l'approche initiale consiste à informer le participant potentiel du projet de recherche et soit d'obtenir l'autorisation de communiquer son nom et ses coordonnées aux chercheurs, soit de lui fournir les coordonnées des chercheurs afin qu'il communique lui-même avec eux s'il souhaite participer à la recherche.
- Le patient intéressé discute alors des détails de l'étude avec un membre de l'équipe de recherche, puis il choisit librement de façon éclairée de participer ou non à la recherche.
Si le document sur les pratiques exemplaires des IRSC articule les pratiques actuelles en la matière, le processus aboutit souvent à une perte importante de participants potentiels, et des biais de sélection s'ensuivent. Une recherche antérieure a constaté que les gens sont plus à l'aise avec le fait qu'un adjoint de recherche qualifié, provenant d'un centre de recherche universitaire, consulte leur dossier à des fins d'admissibilité que si quelqu'un du secrétariat du médecin le fait (Willison et coll., 2007). Par ailleurs, à la lumière des pressions politiques effectuées par des chercheurs en Colombie-Britannique, la nouvelle loi, E-Health (Personal Health Information Access and Protection of Privacy) Act, a une disposition sur la communication directe avec le patient qui doit être approuvée par le commissaire à l'information et à la protection de la vie privée de la province (Abbott, 2008).
2.4.5 Les clauses « coffre-fort » de certaines lois
Dans certaines provinces, des clauses « coffre-fort » permettent aux patients de décider qui aura accès à des renseignements particuliers dans leurs dossiers. Ces clauses sont en général conçues pour s'appliquer dans le contexte de la prestation directe de soins médicaux, où les personnes peuvent limiter l'accès aux renseignements particulièrement confidentiels de leurs dossiers.
Il n'est pas clair si la clause « coffre-fort » doit s'appliquer à la recherche étant donné que l'identité de la personne n'est pas importante, que les données sont anonymisées avant leur utilisation en recherche et qu'il n'y aura pas de tentative de communication avec la personne. Dans ces circonstances, l'utilisation des renseignements à des fins de recherche ne constituerait qu'un risque minime.
Rappelons que, sans parler des clauses « coffre-fort », les chercheurs n'ont généralement pas l'autorisation de communiquer directement avec les patients en se basant sur une connaissance préalable de leur état de santé à moins qu'une relation ait déjà été établie avec la personne. En général, la sélection et la première prise de contact sont effectuées par une personne raisonnablement autorisée à avoir accès à ces renseignements. Dans ce cas, il serait logique que les clauses « coffre-fort » s'appliquent à la personne chargée de trouver des participants potentiels pour une recherche en se basant sur les données contenues dans les dossiers cliniques.
2.5 Culture du milieu de la recherche
2.5.1 Les initiatives internationales pour améliorer l'accès aux résultats de recherche
Traditionnellement, la culture du milieu de la recherche, notamment dans les domaines de l'épidémiologie, de la santé publique, de la recherche sur les services et les politiques en santé, de la santé de la population et de l'amélioration de la qualité, consiste à rendre publics les résultats de recherche le plus rapidement possible. Il est aussi courant de mettre à la disposition d'autres chercheurs les données brutes afin de vérifier les résultats préalablement publiés, de vérifier une nouvelle hypothèse de recherche, ou de compiler de l'information provenant de plusieurs études pour cerner des schémas généraux dans les résultats de plus petites études qui n'ont peut‑être pas une efficacité statistique suffisante pour le faire. Cette pratique fait maintenant partie des directives générales des principaux organismes internationaux de subvention, y compris des National Institutes of Health (NIH) aux États-Unis, du Medical Research Council (MRC) au Royaume-Uni et des Instituts de recherche en santé du Canada (IRSC) (Instituts de recherche en santé du Canada, 2008; Medical Research Council, 2008; National Institutes of Health, 2008).
De plus en plus, cet accès libre est réalisé grâce à la publication de données anonymisées sur un site Web. C'est une pratique particulièrement courante en recherche génomique. Étant donné que la capacité de repersonnaliser les données auparavant considérées comme suffisamment anonymes se développe sans cesse, la pratique consistant à afficher en ligne des données brutes est discutable. Un exemple typique récent a été l'identification de personnes dont les données « anonymisées » étaient contenues dans un ensemble de données génétiques en ligne (Couzin, 2008).
La culture dans le milieu de la recherche de partager librement les données ne concorde pas très bien avec le principe relatif à l'équité dans le traitement de l'information visant à limiter la communication des renseignements personnels. Ce partage va à l'encontre des motifs que les chercheurs ont pour la conservation de l'autorité sur les données. Le détenteur d'un ensemble de données a un avantage concurrentiel lié à la restriction de l'accès à l'information, un avantage qui pourrait le conduire à une nouvelle recherche. C'est notamment le cas s'il existe des possibilités de protection de la propriété intellectuelle et de commercialisation (voir la partie 2.5.3 ci-après).
2.5.2 La conservation des données
En général, les chercheurs sont réticents à détruire des données. Ils sont très au courant des coûts de la collecte de données, notamment des heures-personnes pour le personnel et pour les patients bénévoles, et ils souhaitent autant que possible réutiliser les données à d'autres fins. En outre, les données doivent être conservées pour différentes raisons, dont :
- La possibilité de refaire les analyses, si des résultats sont contestés. On ne peut pas tout simplement forger un autre ensemble de données à partir de la source, car un travail considérable est nécessaire pour préparer les données brutes aux fins de la recherche. De plus, les ensembles de données brutes sont inévitablement revus au fil du temps (révision des données à la source), alors il devient presque impossible de reproduire entièrement un ensemble.
- La nécessité de pistes de vérification, dans le cas d'allégation de fraude comme la fabrication de données.
Cette réticence à détruire des données va à l'encontre du principe relatif à l'équité dans le traitement de l'information limitant la durée de conservation des renseignements personnels. Au lieu de détruire des données, les chercheurs préfèrent les solutions demandant un stockage sécurisé des données à long terme.
2.5.3 La commercialisation de l'innovation et la propriété intellectuelle
L'adoption de la Bayh-Dole Act aux États-Unis en 1982 a marqué un changement d'orientation à l'échelle internationale dans la commercialisation des innovations financées par des fonds publics (Kennedy, 2005). Auparavant, les découvertes réalisées grâce à des fonds publics étaient considérées du domaine public. On se préoccupait de l'attention insuffisante accordée à la mise en œuvre de ces innovations. La solution proposée a été de promouvoir activement la commercialisation des innovations et d'attribuer les droits de propriété intellectuelle à l'organisme et au chercheur responsables de l'innovation. De là est née une grande controverse à savoir si l'effet réel sur l'innovation a été positif ou négatif (Boettiger et Bennett, 2006; Eisenberg et Nelson, 2002; Thursby et Thursby, 2003).
Plusieurs raisons font que l'enjeu est pertinent pour la protection des renseignements personnels et pour l'utilisation des renseignements provenant des DSE à des fins de recherche. En raison de l'introduction d'un élément commercial, les gens souhaitent avoir un meilleur contrôle de l'utilisation qui sera faite de leurs renseignements sur la santé à des fins de recherche (Willison et coll., 2007; Willison et coll., 2008b). Une des applications de recherche les plus intenses pour le DSE interopérable sera dans le domaine de la bioinformatique translationnelle, où il y aura un haut degré de commercialisation des innovations. Par le passé, on a accordé peu d'intérêt à la commercialisation des découvertes des recherches sur la santé publique, les services et les politiques de santé, l'amélioration de la qualité et la santé de la population. Toutefois, au cours des dernières années, l'application des droits de propriété intellectuelle s'est étendue à des méthodes de recherche particulières (Classen, 2006; Walker, 2006). Cette pratique pourrait gagner du terrain étant donné que les chercheurs en génomique se penchent sur les relations entre l'hérédité et les facteurs environnementaux qui influent sur la santé (Anonyme, 2008d).
2.6 Enjeux de gouvernance
La gouvernance de l'utilisation des renseignements sur la santé à des fins de recherche peut être envisagée selon trois échelles : 1) l'examen de chacun des projets de recherche (petite échelle); 2) la gestion des dépôts de données de recherche (moyenne échelle); 3) la gouvernance globale de l'utilisation des renseignements sur la santé en général à des fins de recherche (grande échelle).
2.6.1 L'examen de chacun des projets de recherche
Une étude des réponses des présidents et des administrateurs de CER à des scénarios d'examen de dossiers médicaux et d'établissement de registres et de biobanques a révélé une grande divergence d'opinions concernant la nécessité du consentement à la recherche lorsque celle‑ci suppose l'examen du dossier médical. De plus, une incertitude des CER concernait la portée de leur compétence en matière de surveillance de l'établissement et du fonctionnement des registres (Gibson et coll., 2008; Willison et coll., 2008a). On doit remarquer cependant que cette étude a été réalisée à un moment où plusieurs provinces adoptaient leurs lois sur la protection des données ou en effectuaient la révision, et où les IRSC venaient tout juste de terminer un document sur les pratiques exemplaires en matière de protection de la vie privée dans la recherche en santé (Comité consultatif des Instituts de recherche en santé du Canada sur la protection de la vie privée, 2005). À cette époque, une grande incertitude planait sur ce qui était autorisé ou non; des rapports isolés suggèrent que c'est toujours le cas.
2.6.2 La gestion des dépôts de données de recherche
La recherche institutionnelle en santé s'effectue dans une vaste gamme d'environnements. Le plus grand volume de recherche a lieu dans une poignée de grandes institutions affiliées aux principales universités. Ces institutions sont généralement bien pourvues du côté des ressources : elles ont la capacité de mettre en œuvre et de gérer des processus et des méthodes statistiques pour contrôler la communication des données. Toutefois, un grand nombre de plus petites équipes de recherche sont présentes dans les universités et les centres hospitaliers universitaires et de recherche. Leur taille varie beaucoup, d'un seul chercheur accompagné de quelques adjoints et étudiants à des regroupements de chercheurs se partageant du personnel de recherche. La capacité de gérer de façon sécuritaire l'accès aux données, et la communication de celles-ci, varie elle aussi beaucoup, y compris en matière de politiques sur la manière d'archiver les données une fois la recherche terminéeNote de bas de page 14.
Les plus grandes institutions de recherche font actuellement l'objet d'une vérification périodique de leurs pratiques de gestion des données. Le point faible du système réside dans le grand nombre de plus petits ensembles de données détenus dans les universités et les centres hospitaliers universitaires et de recherche. En ce moment, aucune vérification régulière des pratiques de gestion des données n'est effectuée dans ces environnements. Et dans la plupart d'entre eux, aucun système de soutien central n'effectue la gestion sécurisée des données de recherche. Même si les institutions ont en général des politiques sur la gestion des données, chaque équipe de recherche a la responsabilité du développement et de la maintenance de ses ensembles de données ainsi que de leur sécurité. Le souci accordé à ces aspects est inégal. Un exemple de conséquences d'un tel système de responsabilité décentralisée figure dans le rapport de la commissaire à l'information et à la protection de la vie privée de l'Ontario sur le vol d'un ordinateur portable contenant des données sur des personnes identifiables provenant de plusieurs projets de recherche (Cavoukian, 2007).
Avec l'arrivée du DSE interopérable, les occasions d'établir de plus petits dépôts de données de recherche qui sont mal réglementés se multiplieront peut-être. Selon le système actuel basé sur la communication, les transferts de données peuvent être contrôlés de façon raisonnablement stricte. Le futur DSE sera un système fondé sur l'accès qui permettra peut-être aux personnes autorisées à consulter les dossiers à des fins cliniques de les consulter en vue d'établir leurs propres bases de données, adaptées à la recherche dans leur institution, et même de mettre en commun ces données avec celles de collègues provenant d'autres institutions, à moins que des contrôles d'accès appropriés ne soient mis en place.
2.6.3 Le chevauchement des compétences relativement à la gouvernance de l'utilisation des renseignements sur la santé à des fins de recherche
La surveillance du développement et de l'utilisation des dépôts de données de recherche relève de la compétence de plusieurs organismes. D'un côté, la surveillance de la protection des renseignements personnels des Canadiennes et des Canadiens relève clairement du domaine des commissaires et des ombudsmans à la protection de la vie privée. Cependant, il n'est pas clair si cette surveillance doit relever du pouvoir législatif fédéral ou provincial. La plupart des lois provinciales sur la protection des données de même que la Loi sur la protection des renseignements personnels et les documents électroniques (LPRPDE) ont des dispositions relatives à l'utilisation des renseignements personnels (sur la santé) à des fins de recherche, mais l'orientation est très générale et laisse, en grande partie, la communauté de recherche libre d'établir sa propre méthodologie. La LPRPDE dispense certains types de recherche d'obtenir le consentement à l'utilisation des données recueillies auprès de tierces parties. Une des conditions est que l'organisme informe la commissaire à la protection de la vie privée du Canada avant d'utiliser les renseignements; toutefois, cette condition n'a jamais été appliquée. L'article 39 de la Loi sur la protection des renseignements personnels sur la santé de l'Ontario stipule les quelques registres qui sont assujettis à la surveillance de la commissaire à l'information et à la protection de la vie privée de l'Ontario. Le fait d'étendre cette surveillance à tous les registres de la province surchargerait le Commissariat ontarien.
La protection de la vie privée des participants aux projets de recherche est aussi un élément de la protection de la recherche avec des êtres humains. Au Canada, aucune loi ne porte sur ce sujet. Par contre, cette protection est éclairée par l'Énoncé de politique des trois Conseils : Éthique de la recherche avec des êtres humains (Instituts de recherche en santé du Canada, Conseil de recherches en sciences naturelles et en génie du Canada, et Conseil de recherches en sciences humaines du Canada, 2005). Il n'y a pas non plus d'organisme de certification visant la protection des participants humains aux recherches. Au Canada, des discussions ont lieu depuis quelque temps sur la mise en œuvre d'un programme de certification des programmes de protection des participants humains aux recherches des institutions (Comité d'experts sur la protection des participants humains aux recherches au Canada, 2008). On pourrait insister sur le fait qu'une importante partie du programme de certification devrait être de vérifier l'uniformité des pratiques de gestion de l'information par rapport aux normes actuelles.
D'un autre côté, on pourrait avancer que l'utilisation des renseignements provenant des DSE à des fins de recherche devrait faire partie d'une structure élargie de gouvernance des renseignements sur la santé semblable à celle du National Information Governance Board for Health and Social Care encadrée par le service national de santé au Royaume-Uni (Anonyme, 2008b).
Le risque de chevauchement des compétences ici n'est pas qu'il y aura de la concurrence pour mener le bal, mais plutôt un vide : chaque organisme va s'attendre à ce qu'un autre se charge de diriger.
2.7 Possibilité de pertes de données sources
Comme il est expliqué dans la partie 1.2, certaines recherches en santé nécessitent l'accès à des renseignements non contenus dans le dossier médical. Dans les cas où des couplages de renseignements sur la santé et de renseignements non contenus dans le dossier médical doivent être effectués, il y a un risque que les renseignements externes aient été détruits conformément aux lois sur la protection des renseignements personnels qui stipulent que les données doivent être conservées uniquement pendant le temps nécessaire à l'usage qui en est prévu. L'exemple suivant provient du domaine de la santé et sécurité au travail :
Afin de déterminer si un cancer précis peut être causé par une exposition à un produit chimique d'un environnement de travail en particulier, il peut être nécessaire d'établir les durées d'exposition à l'aide des dossiers des employés. Toutefois, une période de latence de 20 ans ou plus peut séparer l'exposition de son effet. Par conséquent, après le départ d'un employé de l'entreprise, des décennies peuvent s'écouler avant qu'un soupçon ne soit éveillé sur l'exposition au produit chimique en question et le cancer. Si la durée de conservation des dossiers d'employé après la période d'emploi est courte -- p. ex. cinq ans -- alors les renseignements ne seront plus disponibles pour la recherche.
Lorsque les politiques de conservation des données sont établies dans les environnements de travail qui utilisent des matières potentiellement dangereuses, une précaution doit être prise pour veiller à ce que les données soient conservées pendant une période suffisamment longue pour tenir compte d'une utilisation à des fins de recherche. Le principal défi est que les risques ne sont pas exclusivement chimiques (il y a aussi le stress lié au travail, etc.) et que personne ne peut prévoir qu'un risque environnemental, quel qu'il soit, rendra des gens malades dans 10 ou 20 ans. Il n'y a pas de réponse facile à cette question étant donné que des lois ou des politiques restreignent la période de conservation des données à celle requise pour l'utilisation prévue initialement.
2.8 Absence de consensus entre les parties concernées
La question de l'utilisation des renseignements sur la santé à des fins de recherche a été débattue par des chercheurs, des décideurs et des défenseurs de la vie privée pendant de nombreuses années. Malgré cela, les opinions des parties ont peu changé. En 1999, Freeman et Robbins ont décrit les 25 années de débat sur la protection des renseignements personnels ainsi que la collecte et la conservation automatiques des renseignements personnels sur la santé aux États-Unis (Freeman et Robbins, 1999). Les auteurs ont consigné les échecs répétés à trouver un terrain d'entente sur la manière de gérer les renseignements personnels sur la santé de façon à protéger la vie privée tout en permettant diverses utilisations des données à des fins administratives. Ils ont constaté un fait préoccupant : la piètre communication entre les intervenants et l'impossibilité pour eux de mettre le doigt sur l'élément de leur accord ou de leur désaccord quant à la manière dont les données doivent être gérées et contrôlées. S'il y a eu moins de conflit à ce sujet au Canada, il n'y a pas plus de consensus sur plusieurs questions relatives au contrôle des renseignements sur la santé, ainsi qu'à l'accès à ceux-ci, à des fins de recherche et de planification.
D'importantes percées ont déjà été faites pour aborder les conditions permettant l'utilisation des renseignements personnels à des fins de recherche en santé. Par exemple le Bureau de l'éthique des IRSC a effectué un important travail de fond duquel est issu un document internationalement cité, Pratiques exemplaires des IRSC en matière de protection de la vie privée dans la recherche en santé (Comité consultatif des Instituts de recherche en santé du Canada sur la protection de la vie privée, 2005). En outre, le groupe de travail sur l'harmonisation de la recherche et de la protection de la vie privée a rassemblé des normes pour la gestion de la confidentialité et de la sécurité des données (Slaughter, Collins, Roos, Weisbaum, Hirtle, Williams et coll., 2006). Néanmoins, il est toujours nécessaire de poursuivre sur cette lancée et de cerner les zones de convergence des multiples parties concernées afin d'établir les conditions permettant l'utilisation des renseignements personnels à des fins de recherche en santé. Un défi de tous les instants est celui du grand nombre de parties ayant voix au chapitre : les chercheurs, les éthiciens et les avocats, les médecins et les autres dépositaires de données, les gouvernements, les patients et les membres de leur famille. Il est ainsi plus difficile d'amener le changement, notamment lorsque les interactions poussent les parties à se camper dans leurs positions.
2.9 Sommaire
En somme, on a cerné plusieurs défis à relever pour la protection de la vie privée relative à l'utilisation des renseignements personnels à des fins de recherche en santé. La plupart des recherches s'appuient sur des données à l'échelle individuelle tellement détaillées qu'elles doivent être traitées comme des données sur des personnes potentiellement identifiables. Il devient de plus en plus difficile de distinguer la recherche des autres utilisations secondaires des renseignements sur la santé qui ne nécessitent pas le consentement de chacun des patients, et même dans certains cas, de la distinguer des soins cliniques. Étant donné les changements dans la manière d'effectuer la recherche, c'est-à-dire le passage d'études isolées à des registres et des biobanques qui serviront de plateformes de recherche et qui ont un large éventail d'utilisations possibles, l'approche classique en matière de consentement est inadéquate. La prolifération des banques de renseignements combinée à des politiques hétérogènes de gestion des données soulève des préoccupations sur la gestion sécuritaire à long terme des renseignements sur la santé et met en relief la nécessité de surveiller ces banques. Par ailleurs, les pressions de la part des chercheurs augmenteront, ils voudront davantage d'accès direct aux patients afin de communiquer avec eux pour obtenir leur participation aux recherches. Le mécanisme actuel de prise de contact en deux volets ne fonctionne pas bien, mais l'autre solution, soit la communication directe avec les patients par des chercheurs qui n'ont pas de motifs raisonnables d'avoir accès aux renseignements personnels sur la santé, soulève des préoccupations importantes sur la protection de la vie privée en plus d'aller possiblement à l'encontre des lois actuelles sur la protection des renseignements personnels. Ensemble, ces questions demandent davantage qu'un changement marginal ou qu'une tentative de bloquer l'accès aux données. Elles demandent de reconsidérer de fond en comble la manière d'utiliser les renseignements à des fins de recherche ainsi que le rôle de la recherche par rapport aux soins cliniques, à la santé publique et à l'amélioration de la qualité. Étant donné ce que nous savons maintenant, il nous faut réfléchir à ce que serait un système de gestion des renseignements cohérent si nous devions tout refaire.
3. Approches possibles pour aborder l'utilisation des renseignements personnels sur la santé à des fins de recherche dans le contexte des DSE
3.1 Repenser le rôle de la recherche en matière d'utilisation secondaire des renseignements personnels sur la santé
La recherche universitaire a un statut différent de l'amélioration de la qualité, de la santé publique ou de la planification de programme, qui sont en général exemptés de l'obligation d'obtenir le consentement ainsi que d'examens éthiques. Si ces exemptions étaient justifiées par le passé, la pratique actuelle en matière d'amélioration de la qualité, de planification de systèmes et de santé publique consiste à utiliser des outils communs en épidémiologie et expose les patients au même degré de risque que la recherche utilisant les mêmes techniques. Par conséquent, les démarcations sont aujourd'hui artificielles et elles devraient être éliminées. Cette approche semble avoir été adoptée par la Care Record Guarantee en Angleterre, qui décrit l'utilisation qui peut être faite des dossiers de soins (National Information Governance Board, 2007) :
Les personnes prennent soin de vous utilisent votre dossier pour :
- servir de base à toutes les décisions de santé que vous devez prendre avec les professionnels de la santé;
- vous permettre de collaborer avec les prestataires de soins;
- veiller à ce que vous receviez des soins sûrs et efficaces;
- travailler efficacement avec les autres prestataires de soins.
D'autres personnes peuvent avoir besoin d'utiliser votre dossier pour :
- vérifier la qualité des soins (p. ex., vérification clinique);
- protéger la santé du grand public;
- faire le suivi des dépenses du National Health Service;
- gérer le service de santé;
- apporter leur aide pour des enquêtes relatives à des préoccupations ou des plaintes exprimées par vous ou votre famille concernant les soins de santé que vous recevez;
- former des professionnels de la santé;
- collaborer à la recherche. [traduction]
Il a été avancé qu'une démarche proportionnelle au degré de risque pour les personnes doit servir de base à l'examen éthique des activités normales d'amélioration de la qualité ainsi que des recherches visant l'amélioration de la qualité (Alberta Research Ethics Community Consensus Initiative, 2005). Cette démarche éliminerait la démarcation artificielle entre la recherche et les activités normales de surveillance dans ces domaines, et même hausserait le niveau éthique pour les activités d'amélioration de la qualité. Des arguments similaires peuvent servir dans les domaines de la santé publique et de la planification des systèmes. Il sera nécessaire de concevoir des mécanismes d'examen éthique et de les financer adéquatement, et de veiller à ce que les personnes chargées de cet examen reçoivent la formation requise afin de ne pas embourber les activités d'amélioration de la qualité, de planification des systèmes et de santé publique.
Des cadres d'orientation pour le processus d'examen proportionnel devront être élaborés. L'Alberta Consensus Initiative a conçu quelques cadres, mais a été critiqué pour leur aspect excessivement complexe. Un autre cadre pour l'analyse du risque relatif à la protection de la vie privée associé à la recherche a été élaboré par M. Chamberlayne et ses collègues (voir la figure 1) (Chamberlayne, Green, Barer, Hertzman, Lawrence et Sheps, 1998). Ce cadre a été élaboré dans le contexte de l'analyse d'importantes bases de données. De plus, les Pratiques exemplaires des IRSC en matière de protection de la vie privée dans la recherche en santé fournissent des notions utiles (Comité consultatif des Instituts de recherche en santé du Canada sur la protection de la vie privée, 2005).
Étant donné l'utilisation secondaire de longue date des renseignements sur la santé pour l'amélioration de la qualité, la planification des systèmes et la santé publique, on devrait envisager d'étendre l'utilisation primaire des renseignements sur la santé pour qu'elle comprenne la gestion a) de la santé des personnes, b) de la santé des populations et c) du système de santé.
Ce changement notionnel permettrait de tenir compte des activités d'amélioration de la qualité, de santé publique, de santé de la population et de planification des systèmes comme une utilisation primaire des données. En outre, le DSE commun interopérable refléterait une approche simplifiée pour la gestion de cette utilisation étendue. Par extension, la recherche qui appuie une telle utilisation primaire du DSE serait considérée comme une utilisation primaireNote de bas de page 15. Cette logique est cohérente avec le cadre original du DSE présenté par le Conseil consultatif sur l'infostructure de la santé (Conseil consultatif sur l'infostructure de la santé, 1999). De plus, l'architecture pour le DSE commun interopérable a déjà été revue pour tenir compte de l'utilisation du DSE à des fins de santé publique (Inforoute Santé du Canada, 2006).
La désignation de certains types de recherche ou d'activités d'évaluation comme une utilisation primaire du DSE n'éliminerait pas la nécessité d'un examen éthique, ni la question de savoir si des personnes peuvent refuser que leurs renseignements sur la santé soient utilisés pour certains types de recherche (voir la partie 3.2.). Cette désignation serait un changement notionnel qui reconnaîtrait la légitimité, selon les conditions prescrites, de l'utilisation des renseignements personnels à des fins de recherche. Cette notion nécessiterait un processus de consultation publique, puis si elle adoptée, du temps pour la sensibilisation. Elle pourrait également remplacer la nécessité d'un consentement pour un projet précis.
RECOMMANDATIONS
- Les limites artificielles entre la recherche et la pratique en matière d'amélioration de la qualité, de planification des systèmes et de santé publique devraient être éliminées.
- L'utilisation secondaire à des fins de recherche devrait être traitée sur le même pied que les autres utilisations secondaires. De même, l'examen éthique devrait s'appliquer à ces autres utilisations secondaires, de façon proportionnelle aux risques associés à l'utilisation des données.
- Des cadres de pratique doivent être élaborés pour l'évaluation des risques et des avantages de l'utilisation secondaire des renseignements sur la santé.
- À long terme, il faudrait envisager de revoir la notion d'utilisation primaire des renseignements personnels sur la santé afin qu'elle comprenne la gestion de la santé des personnes, de la santé des populations et du système de santé. La recherche appuyant ces activités devrait également être considérée comme une utilisation primaire. Un tel changement devrait faire l'objet d'une consultation publique.
Figure 1. Approche pour l'évaluation des risques en matière de protection de la vie privée pour la recherche par base de données
(Adapté de Chamberlayne et coll., 1998)
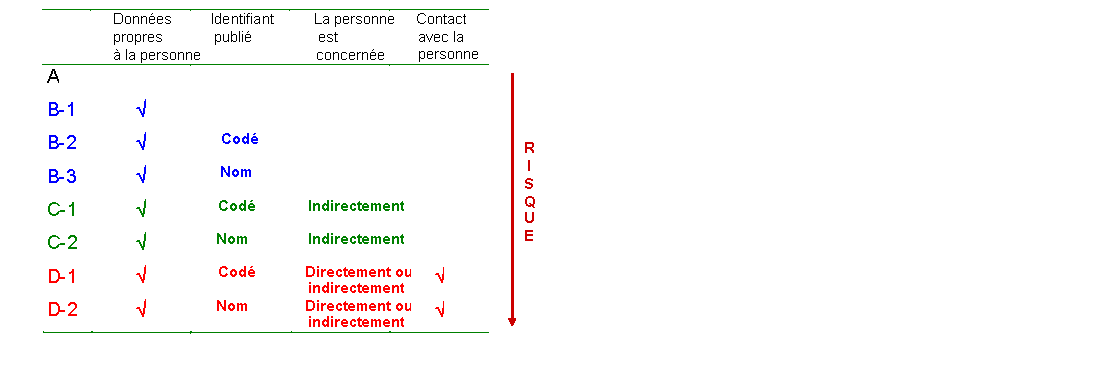
3.2 Consentement
3.2.1 Repenser le rôle du consentement
Dans le contexte de la recherche utilisant l'information génétique, O'Neill allègue que plusieurs lacunes dans le processus de consentement font du consentement valide, sous sa forme traditionnelle, une prouesse cognitive impossible à réaliser, même pour les personnes ayant la pleine capacité de faire des choix éclairés (O'Neill, 2001). Elle avance que l'information est si complexe, opaque et détaillée que personne n'a la capacité de l'expliquer ou de la comprendre pleinement, même pas les chercheurs. De plus, au moment de leur entrée dans le système de soins de santé, les personnes sont très stressées et vulnérables. Selon elle, dans le processus pour passer du paternalisme à l'autonomie dans le domaine de l'éthique, la documentation médicale a surévalué les capacités de l'humain à absorber et à comprendre de l'information complexe. En outre, elle souligne que le contexte du consentement a beaucoup changé, les recherches étant maintenant effectuées dans un environnement où l'on trouve une vaste gamme de renseignements et de systèmes réglementaires complexes. Toutefois, le modèle de consentement demeure largement fondé sur la présomption qu'il y a une relation personnelle entre le chercheur ou clinicien et le patient, dans un environnement où des personnes qui se respectent mutuellement peuvent discuter ouvertement, soupeser les risques et déterminer la meilleure façon d'intervenir. Les mêmes arguments pourraient être utilisés concernant les nombreuses autres utilisations potentielles en recherche des renseignements provenant du dossier de santé électronique.
À la lumière de ces lacunes, O'Neill a indiqué que nous devons passer du consentement individuel pour certaines activités comme la collecte, l'utilisation ou le stockage de données, à un « consentement public » (c.-à-d. un mandat) pour des systèmes de collecte, de stockage, d'utilisation et de communication des données (O'Neill, 2001). Elle souligne que cela réduirait les procédures liées au consentement individuel, sans toutefois éliminer complètement la nécessité d'obtenir un tel consentement. Malheureusement, dans le contexte de ce mandat public pour la mise en place de systèmes pour l'utilisation des renseignements en recherche, O'Neill n'a pas mentionné ce que le consentement individuel devrait impliquer. Les prochains paragraphes comptent des suggestions sur ce à quoi pourrait ressembler un tel système et sur la manière dont le public, à l'échelle individuelle et collective, pourrait participer à la gouvernance de l'utilisation des renseignements personnels sur la santé à des fins de recherche.
3.2.2 Les choix en matière de consentement
Une bonne partie des écrits qui traitent du consentement à l'utilisation des renseignements personnels en recherche adoptent une approche dichotomique, à savoir qu'un consentement traditionnel spécifique à un projet de recherche est requis ou que le projet de recherche est exempté de l'obligation d'obtenir un consentement en vertu de certaines conditions. Il est pratiquement impossible d'obtenir un consentement spécifique à un projet pour la plupart des recherches observationnelles dont traite ce rapport. D'autre part, la possibilité de dire « non » à certains types de recherche renforce grandement la confiance du public à l'égard de l'utilisation de leurs renseignements personnels sur la santé à des fins de recherche (Willison et coll., 2008b).
Un document récent fait état d'une approche élargie qui tient compte du fait qu'il peut y avoir plusieurs niveaux de consentement et que ce dernier peut différer selon le type de recherche et d'autres facteurs (Singleton et Wadsworth, 2006). Par exemple, une personne peut avoir plusieurs choix :
- ne pas utiliser les renseignements personnels pour un type de recherche spécifiqueNote de bas de page 16;
- demander la permission avant chaque utilisation des renseignements;
- obtenir un consentement général pour un type de recherche spécifique, tout en permettant la mise en place de restrictions;
- recevoir une notification avec option de retrait;
- permettre l'utilisation sans notification préalable.
Les personnes pourraient être appelées à faire différents choix concernant l'utilisation secondaire de leurs renseignements personnels, que ce soit à des fins de recherche ou autres. Si on leur propose une multitude de choix pour chaque utilisation, les personnes risquent d'avoir trop de décisions à prendre. Cela pourrait les pousser à faire des choix arbitraires, à s'abstenir de prendre une décision ou à regretter certaines décisions prises (Iyengar et Lepper, 2000; Ram, 2008). Ainsi, on doit toujours garder ce risque en tête lors de la conception d'un système pour s'enquérir des choix en matière de consentement à l'utilisation des renseignements personnels sur la santé.
3.2.3 Moyens suggérés pour obtenir, documenter et communiquer les choix en matière de consentement
Obtenir et documenter les choix des personnes en matière de consentement n'est pas chose facile. La conception et la mise en œuvre d'un système prendront du temps, et il faudra également prendre le temps de bien informer les gens à propos des choix et les laisser prendre leur décision. Il serait peu réaliste de s'attendre à ce que cela puisse s'effectuer par l'entremise du médecin de famille. Les médecins n'ont tout simplement pas le temps d'assumer cette responsabilité et de plus en plus de gens n'ont même pas de médecin de famille. De plus, on peut s'attendre à ce qu'une personne prenne au moins 30 minutes pour recevoir l'information et faire son choix, voire plus longtemps si une multitude de choix s'offrent à elle pour une gamme d'utilisations de ses renseignements personnels sur la santé. Au Québec, une tentative d'obtenir un consentement pour l'utilisation du dossier de santé électronique par l'entremise du médecin de famille a échoué car le temps moyen pour obtenir ce consentement, soit une minute et demie, a été considéré par la plupart des médecins comme excessifNote de bas de page 17.
Informer et transférer de l'information
Une gamme d'approches et de paramètres devront être utilisés pour faire concorder les besoins des personnes avec les technologies appropriées. Par exemple, on pourrait expliquer les diverses utilisations des renseignements personnels sur la santé dans des dépliants et des DVD distribués et diffusés dans les centres hospitaliers, les salles d'attente de cabinets de médecins ou l'aire d'attente publique des bureaux du ministère de la Santé, où l'on va pour le renouvellement de la carte santé. Manson et O'Neill ont signalé l'importance d'informer et non de servir d'intermédiaire en transférant simplement de l'information à une personne (Manson et O'Neill, 2007). Il s'agit d'une étape importante pour bâtir la confiance et favoriser la compréhension. Ainsi, une personne bien renseignée, comme une infirmière à la clinique, devrait pouvoir répondre aux questions et aux préoccupations du public et un espace devrait être réservé pour effectuer le processus de consentement. Il pourrait aussi être possible d'en venir au même résultat à son propre rythme au moyen d'un site Web sécurisé. Encore une fois, on devra aussi avoir la possibilité de parler directement à une personne qui connaît bien le système et les choix offerts.
Documenter et communiquer les choix
Dans le contexte du DSE commun interopérable, il serait en grande partie possible d'obtenir, de documenter et de réviser les choix individuels en matière de consentement au moyen d'un portail dans le dossier électronique du patient, dans son système de dossier de santé personnel (Grant, Wald, Poon, Schnipper, Gandhi, Volk et coll., 2006; Hess, Bryce, Paone, Fischer, McTigue, Olshansky et coll., 2007). Le portail permettrait aux patients de gérer et de communiquer de manière continue leurs choix en matière de consentement pour l'utilisation de leurs renseignements personnels sur la santé à des fins de recherche ou autres (il comprendrait l'équivalent d'une clause « coffre-fort », où le patient peut indiquer son refus quant à certaines utilisations). Le patient pourrait aussi surveiller pour quels types de recherche ses renseignements personnels sont utilisés. Pour ce faire, il faudrait établir des liens avec les données du dépôt de données de recherche décrit à la partie 3.3. Le portail servirait aussi à afficher des avis sur les pratiques d'utilisation des données, un équivalent du NHS Care Record Guarantee (National Information Governance Board, 2007). Le portail permettrait aux patients d'indiquer s'ils souhaitent recevoir les résultats des recherches et de quelle manière (Kohane et coll., 2007).
L'une des façons de simplifier le processus de choix, pour minimiser le nombre de décisions à prendre, est d'assigner différents choix par défaut aux différents types de recherche. Toutefois, dans la plupart des cas, les personnes pourront modifier le choix par défaut, pour le rendre plus ou moins permissif. Les choix par défaut devront être déterminés au terme d'un processus de délibération auquel participeront des chercheurs, des éthiciens, des organismes de réglementation et le public. Fondé sur des travaux précédents sur la participation du public (Willison et coll., 2008b) le tableau 3 présente un exemple de ce que pourraient être ces choix par défaut. Tenant compte des avantages en matière de sécurité pour les personnes et la collectivité, le choix par défaut pour les questions de santé publique et de surveillance des nouveaux médicaments et dispositifs pourrait être l'utilisation obligatoire des renseignements personnels sans possibilité de retrait. En matière de recherche sur l'amélioration de la qualité et la santé de la population, le choix par défaut pourrait être un avis accompagné d'une possibilité de retrait. Ce choix serait justifié par le fait qu'il s'agit de recherche à faible risque n'impliquant aucun contact avec le patient. Également, la possibilité de retrait offre un certain degré de contrôle aux personnes dont les renseignements personnels sont utilisés. Au cours de recherches antérieures, peu de personnes ont choisi de retirer leurs renseignements personnels (entre 1 sur 1 000 et 1 sur 500) et les répercussions d'un nombre aussi faible de retraits sur l'intégrité scientifique sont minimes.
En ce qui concerne la recherche avec des échantillons biologiques liés à des renseignements personnels provenant du dossier de santé, le choix par défaut pourrait être la participation générale avec une possibilité de consentir ou non à des projets spécifiques ou de préciser certaines restrictions quant aux types de recherche pouvant être effectuées. Le fait de passer à un choix de participation par défaut pour ce type de recherche reflète l'aspect plus perturbateur (voire invasif) de la recherche avec des échantillons biologiques.
Dans un même ordre d'idées, les patients pourraient utiliser leur portail pour communiquer leur accord à ce que l'on communique avec eux pour solliciter leur participation à des activités de recherche spécifiques, pour des études fondées sur l'observation ou des essais cliniques. Les personnes intéressées pourraient indiquer si le chercheur peut communiquer directement avec elles ou si elles souhaitent être approchées par l'entremise de leur médecin de famille ou d'un autre fournisseur de soins de santé.
On doit toutefois tenir compte de bon nombre de défis logistiques, y compris :
- l'égalité d'accès aux mécanismes pour communiquer ses choix en matière de consentement (p. ex., par le portail dans le DSE du patient);
- la gestion des attentes relatives au niveau de contrôle sur le portail des patients;
- comment s'assurer que le retrait n'est pas effectué de manière arbitraire;
- les répercussions de la commercialisation des produits de l'innovation sur les choix en matière de consentement.
Tous ces défis nécessitent des recherches approfondies.
RECOMMANDATIONS
- Il a été proposé que l'on remplace la nécessité du consentement individuel pour des activités comme la collecte, l'utilisation ou la conservation des données par un mandat public pour la mise en place de systèmes dans lesquels les données seraient recueillies, stockées, utilisées et divulguées (O'Neill, 2001). Ce changement nécessitera des délibérations publiques et les parties devront en arriver à un consensus.
- Ce mandat public n'écarte pas le choix individuel. En effet, il faudra envisager une approche élargie en matière de consentement à l'échelle individuelle qui inclura l'acceptation globale d'un programme de recherche et la notification avec possibilité de retrait.
- On devra mettre en place des mécanismes pour obtenir et documenter à l'avance les choix individuels en matière de consentement pour différents types d'utilisation en recherche des renseignements personnels. Le présent document comprend des suggestions à cet égard. Le même processus pourra être utilisé pour déterminer les préférences des personnes quant à l'approche à utiliser pour solliciter leur participation à une étude.
- Afin d'éviter la multiplication des décisions, des choix par défaut en matière de consentement sont suggérés pour les différentes utilisations. Par exemple, dans le cas de la santé publique et de la surveillance après commercialisation des médicaments et des dispositifs (qu'il s'agisse ou non de « recherche » officielle), le choix par défaut pourrait être l'inclusion obligatoire des renseignements sur une personne. Pour la recherche en matière de santé publique et d'amélioration de la qualité, le choix par défaut pourrait être une notification avec possibilité de retrait. En ce qui a trait aux études avec des échantillons biologiques, le choix par défaut pourrait être une acceptation globale (voir le tableau 1). Encore une fois, les choix par défaut en matière de consentement devront être établis au terme d'un processus de délibération publique.
- On devra se pencher sur les défis logistiques, comme l'égalité en matière d'accès aux mécanismes permettant la communication des choix individuels (p. ex., les portails pour les patients dans le DSE), la gestion des attentes par rapport au niveau de contrôle offert sur le portail du patient, la manière de s'assurer que l'option de retrait n'est pas offerte capricieusement et les répercussions de la commercialisation des résultats d'innovation sur les choix en matière de consentement.
| Exemple d'utilisation en recherche* | Choix par défaut proposé | Choix proposés pour le patient |
|---|---|---|
| Surveillance en santé publique, sans contact avec les personnes ni commercialisation des produits de l'innovation | Inclusion obligatoire** | Aucun |
| Surveillance après commercialisation de nouveaux médicaments et dispositifs, sans contact avec les personnes ni commercialisation des produits de l'innovation | Inclusion obligatoire** | Aucun |
| Amélioration de la qualité et planification des systèmes, sans contact avec les personnes ni commercialisation des produits de l'innovation | Notification avec possibilité de retrait*** |
|
| Santé de la population, sans contact avec les personnes ni commercialisation des produits de l'innovation | Notification avec possibilité de retrait*** |
|
| Recherche avec des liens entre les échantillons biologiques et les renseignements personnels sur la santé, avec ou sans commercialisation des produits de l'innovation | Acceptation globale |
|
| Inclusion dans un registre de personnes consentantes à ce que l'on communique avec elles pour solliciter leur participation à des recherches | Communication initiale par l'entremise d'un membre du réseau de soins | Le chercheur peut établir le premier contact directement avec la personne. |
| * Nota : Les exemples présentés simplifient le rôle de la commercialisation des produits de l'innovation. Par exemple, la surveillance de la santé publique constitue un bien public pur, c'est-à-dire qu'il n'y a pas de profits pour le privé ni de restrictions en matière de propriété intellectuelle. Selon la recherche inductive, les choix en matière de consentement sont très influencés par la présence d'un élément de profit. ** À des fins de transparence, il devrait aussi y avoir une forme de notification publique concernant les diverses utilisations des renseignements. ***La notification pourra être personnalisée lorsque cela sera possible (une fois les portails vers les DSE des patients mis en place). |
||
3.3 Contexte souhaitable pour la recherche
3.3.1 Les infrastructures
Peu importe que les utilisations des renseignements personnels sur la santé à des fins de recherche soient considérés de nature primaire ou secondaire, des infrastructures devront être mises en place afin d'assurer leur validité des points de vue éthique et scientifique, et d'assurer la présence de mesures de protection efficaces. L'architecture des bases de données de recherche diffère de celle des bases de données conçues pour fournir des soins de santé. En conséquence, dans le contexte d'un DSE interopérable, pour maintenir une capacité analytique adéquate, on doit maintenir des bases de données de recherche séparées. Cela est dû en partie au fait que le DSE est conçu pour être utilisé pour des transactions en temps réel dans le domaine des soins cliniques, ce qui ne permet pas un traitement analytique approfondi des données pour les analyses de type épidémiologique (Sanders et Protti, 2008). La capacité analytique doit être ajoutée dès le départ, car le fait d'ajouter une fonction par la suite mène souvent à une diminution de la qualité des donnéesNote de bas de page 18.
Par le passé, la capacité analytique a été mal gérée par les gouvernements. Plusieurs provinces ont donc fait appel à des instituts de recherche affiliés à des universités pour obtenir ce type de service, par exemple, le Population Health Research Unit (PHRU) en Nouvelle-Écosse, l'Institut de recherche en services de santé (IRSS) en Ontario, le Centre d'élaboration et d'évaluation de la politique des soins de santé au Manitoba (CEEPSS) et le Centre for Health Services and Policy Research (CHSPR) en Colombie‑Britannique. Ces centres sont dirigés par des chercheurs du milieu universitaire qui, en plus d'effectuer des analyses pour leurs provinces, ont mené leurs propres recherches. En fait, ils constituent des dépositaires de données, tout comme les hôpitaux. Des articles dans les lois provinciales accordent ce statut spécial aux institutions (Kosseim et Brady, 2008). Dans ces centres, les données brutes sont nettoyées, couplées, dépersonnalisées et préparées pour la recherche au moyen de protocoles rigoureux afin de limiter l'accès aux données sur des personnes identifiables à un nombre restreint de chercheurs. En outre, des mécanismes d'évaluation éthique sont en place et l'on procède périodiquement à des vérifications externes des pratiques de gestion de donnéesNote de bas de page 19 (Slaughter et coll., 2006).
À l'IRSS et au CEEPSS, les données brutes ne sortent jamais de l'institution (modèle enclavé). Toutefois, au CHSPR, certaines données sélectionnées sont communiquées afin de répondre à des demandes spécifiques en recherche. De plus, des dispositions dans l'entente d'utilisation stipulent que les données brutes doivent être détruites à des moments prédéterminés. Dans le modèle enclavé, l'accès aux données de recherche est limité par des facteurs géographiques et réservé aux membres. Il s'agit d'un modèle hautement sécurisé pour la gestion de données. Par contre, il existe certaines inégalités dans l'accès aux données selon le secteur géographique. En Ontario, on tente de remédier à ce problème par la mise en place de sites satellites spécialisés permettant un accès « câblé » direct aux serveurs de l'IRSS ainsi que de mesures de protection rigoureuses.
Lorsque les données sont communiquées directement aux chercheurs, l'accès est grandement amélioré, mais les mesures de contrôle de l'utilisation des données brutes, une fois divulguées, sont possiblement plus faibles puisque l'on se fie à des tiers pour maintenir les mesures de sécurité en place (Black, McGrail, Fooks, Baranek et Maslove, 2005). La divulgation sécurisée des données directement aux chercheurs pourrait être possible au moyen d'une technologie de gestion des droits d'utilisation électronique intégrée directement au système de divulgation des données. Ainsi, on pourrait fixer des limites concernant les ordinateurs pouvant recevoir les données et la durée d'utilisation autorisée de ces données. En affirmant que l'identifiabilité existe dans un continuum, El Emam a suggéré que les dépositaires de données décident de l'étendue de la dépersonnalisation des données avant de les divulguer, en fonction des mesures de contrôle dont le destinataire dispose pour assurer la sécurité des données (El Emam, 2008). Cela présuppose que les dépositaires de données disposent de techniques immédiatement utilisables pour ajuster le niveau de dépersonnalisation des données à être divulguées. Par exemple, ils pourraient procéder à la réduction des détails (p. ex. remplacer la date de naissance par l'année de naissance) et à une perturbation aléatoire des données (El Emam et coll., 2007)Note de bas de page 20. Actuellement, ces techniques de limitation et de contrôle de la divulgation ne sont pas d'usage général parmi les dépositaires de données. La mise en place de ces technologies et la formation connexe pour le personnel devraient être encouragées.
RECOMMANDATIONS
- La pratique d'afficher directement les données brutes en ligne, même si ces données sont anonymes, devrait être découragée. On pourrait plutôt afficher l'existence des dépôts de données en ligne mais avec des mécanismes garantissant un accès facile aux données pour les chercheurs, à des fins de recherche de bonne foi, ainsi que des contrôles appropriés relatifs à la divulgation et des contrats d'utilisation.
- On devrait poursuivre la création de dépôts de données sécurisés avec des mécanismes de contrôle de l'accès et de la divulgation appropriés (Jabine, 1993; National Research Council, 1997).
- Les nouvelles technologies en matière d'accès à distance sécurisé pourraient être appliquées à ces dépôts. Tant les dépositaires de données que les chercheurs pourraient suivre une formation sur l'utilisation de ces technologies.
3.3.2 La gouvernance
Examen des projets de recherche individuels
La partie 2.4.1 décrit les défis associés aux variations dans les décisions des CER concernant les conditions nécessaires pour permettre l'utilisation sans consentement des renseignements personnels sur la santé à des fins de recherche. L'une des approches possibles est de mettre au point une gamme de tutoriels fondés sur des cas pour les membres des CER, les dépositaires de données et les chercheurs. Il serait ainsi possible d'améliorer et de préciser les études de cas élaborées par l'IRSC en 2002 (Groupe de travail de l'IRSC sur les études de cas, 2002). Dans le cas de la recherche se servant du DSE commun interopérable et des échantillons biologiques, les questions de confidentialité et de protection de la vie privée peuvent être assez techniques pour nécessiter l'expertise d'organismes d'examen spécialisés et centralisés qui ont la capacité d'examiner les protocoles de recherche impliquant l'accès aux données du DSE et l'utilisation d'échantillons biologiques.
Gestion des dépôts de données de recherche
La prolifération des dépôts de données de recherche pourrait être gérée par l'obligation (au moyen d'une loi ou d'un règlement) d'obtenir une autorisation et un enregistrement pour tous les registres, bases de données et biobanques de la province, assortis de certaines conditions, par exemple :
- une justification énonçant pourquoi les dépôts de données existants ne pouvaient être utilisés;
- le respect de normes de gestion de la vie privée, de la confidentialité, de la sécurité et de la gouvernance;
- une formation appropriée pour le personnel et les chercheurs;
- des vérifications périodiques des pratiques d'utilisation des renseignements.
Dans la mesure du possible, les dépôts d'échantillons et de données devraient demeurer sous la responsabilité des institutions, et non des chercheurs. Les institutions seraient donc chargées de stocker les données et de gérer les dépôts de manière sécuritaire ainsi que de mettre en place des contrôles d'accès et d'autres mesures de protection. Cela permettrait aussi d'assurer que les CER ont été consultés, le cas échéant, avant que les données ne soient consultées ou communiquées pour des projets de recherche spécifiques. En outre, cela permettrait la collecte et la mise à jour continues par l'institution d'ensembles de données étoffés, tout en respectant les principes relatifs à l'équité dans le traitement de l'information concernant la limitation de la collecte de données en limitant la quantité de données consultées ou divulguées pour les chercheurs, en fonction de ce qui est nécessaire pour bien mener la recherche. Grâce à l'enregistrement des bases de données et des biobanques, il serait possible de demeurer au courant de certaines études en cours.
Gouvernance globale des utilisations des renseignements sur la santé en recherche
Étant donné les changements actuels en matière d'accréditation des programmes de protection des sujets humains de recherche au Canada et l'absence de mention des utilisations en recherche dans le plan directeur d'Inforoute, il y a clairement un manque de leadership en matière de gouvernance. Les commissaires et ombudsmans à la protection de la vie privée fédérale et provinciaux devraient décider s'ils souhaitent jouer un rôle de chef de file à cet égard. Dans l'affirmative, des mesures devront être prises en collaboration avec d'autres superviseurs potentiels de l'utilisation des renseignements sur la santé à des fins de recherche.
Peu importe quel sera l'organisme de surveillance principal en matière de protection de la vie privée, il devra s'assurer, entre autres, que les institutions maintiennent un inventaire :
- des bases de données et des biobanques au sein de leur organisation;
- des études de recherche fondées sur ces bases de données;
- des divulgations de données à d'autres institutions (y compris dans un dépôt central).
Des rapports annuels pourraient être déposés auprès de l'organisme de réglementation principal responsable des questions de protection de la vie privée et des données, et les autres organismes de réglementation pourraient avoir accès à ces renseignements. Les institutions de recherche seraient assujetties à des vérifications périodiques par l'organisme de réglementation principal et les rapports de ces vérifications seraient envoyés aux autres organismes de réglementation et accessibles au public. Dans un souci d'amélioration continue de la qualité, l'organisme de réglementation principal devra jouer un rôle de conseiller pour les dépositaires de données.
Gestion du détournement d'usage de l'information
En terminant, les dépôts de données de recherche peuvent constituer des outils analytiques très performants. Toutefois, les caractéristiques de ces dépôts qui suscitent l'intérêt des chercheurs augmentent aussi les risques d'atteinte à la vie privée. Lorsque l'on mettra en place l'infrastructure de recherche, il faudra se demander comment mieux surveiller et limiter les utilisations contraires aux objectifs de recherche initiaux des dépôts de données de recherche. Par exemple, pour le dossier clinique, des préoccupations ont été soulevées concernant la divulgation forcée de renseignements dans le cadre de demandes d'emploi ou d'assurance (Rothstein et Talbott, 2006). Une préoccupation semblable pourrait être soulevée dans le cas des divulgations forcées de données provenant des ensembles de données de recherche en raison des activités de surveillance de la sécurité du gouvernement, comme ce fut le cas pour la base de données française Edvige (Ozimek, 2008). Ces exemples sont des cas clairs d'utilisations contraires aux utilisations initiales prévues. Par contre, ce ne sera pas si clair dans tous les cas. Au Canada, il n'y a actuellement rien d'équivalent aux certificats de confidentialité émis aux États-Unis qui servent à protéger les chercheurs de la divulgation forcée de données à propos de sujets de recherche (Coffey et Ross, 2004; Wolf, Zandecki et Lo, 2004). Une question qui demeure toutefois est de savoir si ce certificat de confidentialité serait toujours valide si l'on invoquait la USA PATRIOT Act ou d'autres lois semblables de défense nationale.
RECOMMANDATIONS
Examen des projets de recherche individuels
- Afin d'améliorer la cohérence dans les décisions des CER sur les conditions de l'exemption à l'obligation d'obtenir un consentement pour la recherche, des études de cas approfondies devront être élaborées et communiquées dans le cadre d'une approche de formation continue pour les comités d'éthique de la recherche et les chercheurs. Ces études de cas pourraient se fonder sur les études effectuées par l'IRSC en 2002.
- Dans le cas de la recherche faisant appel au DSE commun interopérable et aux échantillons biologiques, on devrait se pencher sur la mise en place d'organismes d'examen spécialisés et centralisés qui auraient la capacité d'examiner les protocoles pour ce type de recherche.
Gestion des dépôts de données de recherche
- Les données et les tissus conservés à des fins de recherche devraient être enregistrés auprès du Comité d'éthique de la recherche de l'institution. Tout projet de recherche fondé sur ces éléments conservés devrait aussi être enregistré dans la base de données. Si les bases de données et les biobanques étaient enregistrées, il serait alors possible de demeurer au courant des études effectuées au moyen de ces sources de données.
- Autant que possible, les dépôts de données et d'échantillons devraient demeurer sous la responsabilité des institutions et non des chercheurs. Ainsi, on pourrait mieux assurer une gestion sécurisée à long terme des données de recherche.
Gouvernance globale des utilisations des renseignements sur la santé en recherche
- Vu le manque actuel de leadership dans la gouvernance de la recherche, les commissaires et ombudsmans à la protection de la vie privée fédérale et provinciaux devraient décider s'ils souhaitent jouer un rôle de chef de file à cet égard. Dans l'affirmative, des mesures devront être prises en collaboration avec d'autres superviseurs potentiels de l'utilisation des renseignements sur la santé à des fins de recherche.
3.4 Sensibilisation de toutes les parties intéressées, y compris le public
On a réalisé des progrès considérables quant aux conditions selon lesquelles les renseignements personnels peuvent être utilisés à des fins de recherche. Notamment, le Bureau de l'éthique de l'IRSC a effectué des travaux préparatoires importants qui ont mené à l'ouvrage de renommée internationale Pratiques exemplaires des IRSC en matière de protection de la vie privée dans la recherche en santé (Comité consultatif des IRSC sur la protection de la vie privée, 2005). De plus, le groupe de travail sur l'harmonisation de la recherche et de la protection de la vie privéede la confidentialité et de la sécurité des données (Slaughter et coll., 2006). On doit se fonder sur ces réalisations, et sur d'autres réussites, pour repérer les zones de convergence et de divergence entre toutes les parties intéressées quant aux conditions selon lesquelles les renseignements personnels peuvent être utilisés à des fins de recherche. Le meilleur moyen d'y arriver serait de tenir une série de dialogues délibératifs éclairés par des faits avec tous les groupes concernés par l'utilisation des renseignements personnels sur la santé à des fins de recherche.
Le public n'a pas participé à ces discussions. En général, les membres du public sont peu informés à propos des recherches qui sont effectuées au moyen de leurs renseignements personnels sur la santé et des recherches qui se préparent (Robling, Hood, Houston, Pill, Fay et Evans, 2004). On a sollicité la participation du public au Canada et à l'étranger concernant l'élaboration des politiques dans ce domaine (Damschroder, Pritts, Neblo, Kalarickal, Creswell et Hayward, 2007; Robling et coll., 2004; Willison et coll., 2008b).
Le public devrait être inclus dans le processus d'examen à mesure que nous progressons vers la mise en place de modèles opérationnels (infrastructures, approches relatives au consentement, gouvernance) concernant l'utilisation des renseignements personnels sur la santé à des fins de recherche. Les premiers efforts en ce sens devraient fournir des occasions de demander des commentaires sur l'acceptabilité des modèles proposés d'utilisation en recherche. De plus, on devra poursuivre les efforts pour sensibiliser les membres du public à propos de l'utilisation de leurs renseignements personnels sur la santé à des fins de recherche et des choix dont ils disposent pour contrôler cette utilisation.
En plus de consulter et d'informer le public sur les utilisations des renseignements personnels sur la santé en recherche, on devra sérieusement songer à intégrer dans la structure de gouvernance globale un moyen de recueillir les commentaires du public de manière continue dans le cadre du processus de prise de décisions et à introduire des règles de partage des bénéfices afin que la collectivité profite d'un avantage financier (pour des recherches futures par exemple). On pourrait ainsi mieux traiter des questions épineuses comme la commercialisation des résultats de recherche et les droits de propriété intellectuelle connexes. Par ailleurs, on a suggéré une participation semblable du public en matière de gouvernance dans le contexte des biobanques et de la recherche sur les cellules souches (Haddow, Laurie, Cunningham-Burley et Hunter, 2007; Winickoff, 2006; Winickoff et Winickoff, 2003).
RECOMMANDATIONS
- On devra discuter des modèles opérationnels pour l'utilisation des renseignements personnels sur la santé à des fins de recherche (infrastructures, approches relatives au consentement, gouvernance) avec toutes les parties intéressées, y compris le public, dans le cadre de forums. Ces initiatives devraient permettre de recueillir des commentaires sur l'acceptabilité des modèles proposés pour les utilisations des renseignements personnels en recherche.
- On devra redoubler d'efforts pour sensibiliser les membres du public à propos de l'utilisation de leurs renseignements personnels sur la santé à des fins de recherche et des choix dont ils disposent pour contrôler cette utilisation.
- Concevoir un mécanisme d'apport continu significatif du public dans la structure de gouvernance globale.
4. Conclusion
Dans cette analyse, la recherche observationnelle dans le domaine de la santé et la protection de la vie privée sont deux éléments considérés comme étant d'intérêt public. Des divergences existent entre ces deux éléments mais l'on suggère des moyens de les faire coexister sans heurt. Des changements marginaux ne sont pas suffisants. Plusieurs avancées techniques donnent l'occasion de modifier de manière importante notre approche en matière de recherche observationnelle et de protection de la confidentialité et de la sécurité. Par exemple, la mise en place du DSE interopérable, l'élaboration de plateformes de recherche au moyen de dépôts de données et de biobanques et l'utilisation accrue des données de dossier médical en recherche à mesure que la bioinformatique translationnelle prend de l'importance. On devra rapidement se pencher sur la question de la gouvernance et des infrastructures, pour éviter que le processus actuel de « politique par procrastination » (Kosseim et Brady, 2008) ne mène à d'autres modifications ponctuellesinsuffisantes et inefficaces à la gouvernance de la recherche, plutôt qu'à la mise en œuvre d'une solution globale.
BIBLIOGRAPHIE
ABBOTT, G. E-Health (Personal Health Information Access and Protection of Privacy) Act, 2008. À l'adresse : http://www.leg.bc.ca/38th4th/3rd_read/gov24-3.htm.
ADIDA, B., et I.S. KOHANE. GenePING: secure, scalable management of personal genomic data, « BMC Genomics », 7, 93, 2006.
ALBERTA RESEARCH ETHICS COMMUNITY CONSENSUS INITIATIVE. ARECCI Recommendations - FINAL. Protecting People While Increasing Knowledge: Recommendations for a Province-wide approach to Ethics Review of Knowledge-generating Projects (Research, Program Evaluation, and Quality Improvement) in Health Care. Edmonton (Alberta), Alberta Heritage Foundation for Medical Research, 2005.
AMERICAN MEDICAL INFORMATICS ASSOCIATION. AMIA Strategic Plan, 2007. À l'adresse : http://www.amia.org/inside/stratplan/.
ANONYME. Ensuring the inclusion of clinical research in the nationwide health information network, 2008a. À l'adresse : http://www.fastercures.org/pdf/FC_AHRQ-NCRR_report.pdf.
ANONYME. Livre blanc sur la gouvernance de l'information dans le dossier de santé électronique (DSE) interopérable, Ottawa, Inforoute Santé du Canada, 2007b. À l'adresse : http://www2.infoway-inforoute.ca/Documents/Information%20Governance%20Paper%20Final_20070328_FR.pdf.
ANONYME. National Information Governance Board for Health and Social Care, 2008b. À l'adresse : http://www.connectingforhealth.nhs.uk/nigb.
ANONYME. NHGRI Seeks DNA Sequencing Technologies Fit for Routine Laboratory and Medical Use, 2008c. À l'adresse : http://www.genome.gov/27527585.
ANONYME. NIH Announces New Initiative in Epigenomics, 2008d. À l'adresse : http://www.nih.gov/news/health/jan2008/od-22.htm.
ANONYME. Report on statistical disclosure limitation methodology. Statistical policy working paper 22, Washington (D.C.), Statistical Policy Office, Office of Information and Regulatory Affairs, Office of Management and Budget, mai 1994.
ANONYME. UKCRC R&D Advisory Group to Connecting For Health: The Report of Research Simulations, UK Clinical Research Collaboration, 2007a. À l'adresse : http://www.ukcrc.org/pdf/CfH report June 07 full.pdf.
ASSOCIATION CANADIENNE DE NORMALISATION. CAN/CSA-Q830-96, Code type sur la protection des renseignements personnels, Norme nationale du Canada, Ontario, Association canadienne de normalisation, 1996.
BLACK, C., K. MCGRAIL, C. FOOKS, P. BARANEK et L. MASLOVE. Data, Data, everywhere...: Improving access to population health and health services research data in Canada, Ottawa (Canada), Canadian Policy Research Networks, 2005.
BOETTIGER, S., et A.B. BENNETT. Bayh-Dole: if we knew then what we know now, « Nature Biotechnology », 24(3), 320-323, 2006.
CAULFIELD, T., A.L. MCGUIRE, M. CHO, J.A. BUCHANAN, M.M. BURGESS, U. DANILCZYK, C.M. DIAZ, K. FRYER‑EDWARDS, S.K. GREEN, M.A. HODOSH, E.T. JUENGST, J. KAYE, L. KEDES, B.M. KNOPPERS, T. LEMMENS, E.M. MESLIN, J. MURPHY, R.L. NUSSBAUM, M. OTLOWSKI, D. PULLMAN, P.N. RAY, J. SUGARMAN et M. TIMMONS. Research ethics recommendations for whole-genome research: consensus statement, « Plos Biology », 6(3), e73, 2008.
CAULFIELD, T., R.E.G. UPSHUR et A. DAAR. DNA databanks and consent: A suggested policy option involving an authorization model, « BMC Medical Ethics », 4 1-4, 2003.
CAVOUKIAN, A. Order H0-004. Ottawa, Bureau du commissaire à l'information et à la protection de la vie privée/Ontario, 2007. À l'adresse : http://www.ipc.on.ca/images/Findings/up-3ho_004.pdf.
CHAMBERLAYNE, R., B. GREEN, M.L. BARER, C. HERTZMAN, W.J. LAWRENCE et S.B. SHEPS. Creating a population-based linked health database: a new resource for health services research, « Rev can santé publ », 89(4), 270-273, 1998.
CLASSEN, J.B. Enhanced funding of pharmacoepidemiology through patenting the disclosure of adverse event information, « Pharmacoepidemiology & Drug Safety », 15(6), 390-393, 2006.
CLAYTON, E.W., et L.F. ROSS. Implications of disclosing individual results of clinical research, « JAMA », 295(1), 37-38, 2006.
COFFEY, M.J., et L. ROSS. Human subject protections in genetic research, « Genetic Testing », 8(2), 209-213, 2004.
COMITÉ CONSULTATIF DES INSTITUTS DE RECHERCHE EN SANTÉ DU Canada SUR LA PROTECTION DE LA VIE PRIVÉE. Pratiques exemplaires des IRSC en matière de protection de la vie privée dans la recherche en santé - septembre 2005, Ottawa, Travaux publics et Services gouvernementaux Canada, 2005. À l'adresse : http://www.cihr-irsc.gc.ca/f/documents/pratiques_ex_protection_vie__prive.pdf.
COMITÉ D'EXPERTS SUR LA PROTECTION DES PARTICIPANTS HUMAINS AUX RECHERCHES AU CANADA. Aller de l'avant : rapport final, Ottawa, 2008. À l'adresse : http://www.hrppc-pphrc.ca/francais/sponsors.html.
CONSEIL CONSULTATIF SUR L'INFOSTRUCTURE DE LA SANTÉ. Inforoute Santé du Canada, Voies vers une meilleure santé, Ottawa, Publications de Santé Canada, 1999.
COUZIN, J. Genetic privacy. Whole-genome data not anonymous, challenging assumptions. « Science », 321(5894), 1278, 2008.
DAMSCHRODER, L.J., J.L. PRITTS, M.A. NEBLO, R.J. KALARICKAL, J.W. CRESWELL et R.A. HAYWARD. Patients, privacy and trust: patients' willingness to allow researchers to access their medical records, « Soc.Sci.Med. », 64(1), 223-235, 2007.
DROLET, B.C., et K.B. JOHNSON. Categorizing the world of registries, « Journal of Biomedical Informatics », 41(6), 1009-1020, 2008.
EISENBERG, R.S., et R.R. NELSON. Public vs. proprietary science: a fruitful tension?, « Academic Medicine », 77(12:Pt 2), t-9, 2002.
EL EMAM, K. De-identifying health data for secondary use: A framework, 2008. À l'adresse : http://www.ehealthinformation.ca/documents/SecondaryUseFW.pdf.
EL EMAM, K., E. JONKER, S. SAMS, E. NERI, N. NEISA, T. GAO et S. CHOWDHURY. Pan‑Canadian De-identification Guidelines for Personal Health Information, Ottawa (Ontario), 2007. À l'adresse : http://www.ehealthinformation.ca/documents/OPCReportv11.pdf.
EUROSTAT. Manual of disclosure control methods, Luxembourg, Office for Official Publications of the European Communities, 1996.
FRANSEN, G.A., C.J. VAN MARREWIJK, S. MUJAKOVIC, J.W. MURIS, R.J. LAHEIJ, M.E. NUMANS, N.J. DE WIT, M. SAMSOM, J.B. JANSEN et J.A. KNOTTNERUS. Pragmatic trials in primary care. Methodological challenges and solutions demonstrated by the DIAMOND‑study, « BMC Medical Research Methodology », 7, 16, 2007.
FREEMAN, P., et A. ROBBINS. The U.S. health data privacy debate, « Journal of Technology Assessment in Health Care », 15(2), 316-331, 1999.
GIBSON, E., D.J. WILLISON, K. BRAZIL, M.D. COUGHLIN, C. EMERSON, F. FOURNIER, L. SCHWARTZ, K.V. SZALA‑MENEOK et K. WEISBAUM. Who's Minding the Shop? The Role of Canadian Research Ethics Boards in the Creation and Uses of Registries and Biobanks, « BMC Med.Ethics », 9(17), doi:10.1186/1472-6939-9-17, 2008.
GRADY, D.G., et N. HEARST. Using Existing Databases. Dans S.B. Hulley, S.R. Cummings, W.S. Browner, D.G. Grady, et T.B. Newman (éds.), « Designing Clinical Research » (p. 207‑221). Philadelphie, Wolters Kluwer / Lippincott Williams & Wilkins, 2007.
GRANT, R.W., J.S. WALD, E.G. POON, J.L. SCHNIPPER, T.K. GANDHI, L.A. VOLK et B. MIDDLETON. Design and implementation of a web-based patient portal linked to an ambulatory care electronic health record: patient gateway for diabetes collaborative care, « Diabetes Technology & Therapeutics », 8(5), 576-586, 2006.
HADDOW, G., G. LAURIE, S. CUNNINGHAM‑BURLEY et K.G. HUNTER. Tackling community concerns about commercialisation and genetic research: a modest interdisciplinary proposal, « Social Science & Medicine », 64(2), 272-282, 2007.
HESS, R., C.L. BRYCE, S. PAONE, G. FISCHER, K.M. MCTIGUE, E. OLSHANSKY, S. ZICKMUND, K. FITZGERALD et L. SIMINERIO. Exploring challenges and potentials of personal health records in diabetes self-management: implementation and initial assessment, « Telemedicine Journal & E-Health », 13(5), 509-517, 2007.
INFOROUTE SANTÉ DU CANADA. Architecture SDSE, 2006. À l'adresse : http://knowledge.infoway-inforoute.ca/fr/knowledge-centre/ehrs-blueprintv2.aspx.
INSTITUTS DE RECHERCHE EN SANTÉ DU CANADA, Conseil de recherches en sciences naturelles et en génie du Canada, et Conseil de recherches en sciences humaines du Canada. Énoncé de politique des trois Conseils : éthique de la recherche avec des êtres humains, 1998 (avec les modifications de 2000, 2002 et 2005). Ottawa, Les trois Conseils, 2005.
INSTITUTS DE RECHERCHE EN SANTÉ DU CANADA. Politique sur l'accès aux résultats de la recherche des IRSC, 2008. À l'adresse : http://www.cihr-irsc.gc.ca/f/32005.html.
INSTITUTS DE RECHERCHE EN SANTÉ DU CANADA. Stratégie de commercialisation et d'innovation des IRSC, 2005. À l'adresse : http://www.cihr-irsc.gc.ca/f/30162.html#2_Defining.
IRSC GROUPE DE TRAVAIL SUR LES ÉTUDES DE CAS. L'utilisation secondaire des renseignements personnels dans la recherche en santé : études de cas, Ottawa, Travaux publics et Services gouvernementaux Canada, 2002. À l'adresse : http://www.cihr-irsc.gc.ca/f/pdf_15568.htm.
IYENGAR, S.S., et M.R. LEPPER. When choice is demotivating: can one desire too much of a good thing? « Journal of Personality & Social Psychology », 79(6), 995-1006, 2000.
JABINE, T.B. Procedure for restricted data access, « Journal of Official Statistics », 9, 537-589, 1993.
KENNEDY, D. Bayh-Dole: almost 25, « Science », 307(5714), 1375, 2005.
KHO, M., M. DUFFETT, D.J. WILLISON, D.J. COOK et M.C. BROWERS, M.C. Does written informed consent introduce selection bias in observational studies using medical records? A systematic review, « BMJ », (Accepté pour la publication), 2008.
KOHANE, I.S., K.D. MANDL, P.L. TAYLOR, I.A. HOLM, D.J. NIGRIN et L.M. KUNKEL. Medicine. Reestablishing the researcher-patient compact, « Science », 316(5826):836-7, 2007.
KOSSEIM, P., et M. BRADY. Policy by procrastination: Secondary use of electronic health records for health research purposes, « Revue de droit et santé de McGill », 2 5-45, 2008.
MACLURE, M., B. CARLETON et S. SCHNEEWEISS. Designed delays versus rigorous pragmatic trials: lower carat gold standards can produce relevant drug evaluations, « Medical Care », 45(10:Supl 2), Supl-9, 2007.
MALIN, B., et L. SWEENEY. Re-identification of DNA through an automated linkage process, Proceedings / AMIA, Annual Symposium-7, 2001.
MANSON, N.C., et O. O'NEILL.Rethinking informed consent in bioethics, New York, Cambridge University Press, 2007.
MCGUIRE, A.L., et R.A. GIBBS. Genetics. No longer de-identified. « Science », 312(5772), 370‑371, 2006.
MEDICAL RESEARCH COUNCIL. Principles for access to, and use of, MRC funded research data, 2008. À l'adresse : http://www.mrc.ac.uk/PolicyGuidance/EthicsAndGovernance/DataAccess/index.htm.
MEYSTRE, S.M., G.K. SAVOVA, K.C. KIPPER‑SCHULER et J.F. HURDLE. Extracting information from textual documents in the electronic health record: a review of recent research, « Yearbook of Medical Informatics », 128-144, 2008.
MILLER, F.A., M. GIACOMINI, C. AHERN, J.S. ROBERT et S. DE LAAT. When research seems like clinical care: a qualitative study of the communication of individual cancer genetic research results, « BMC Medical Ethics », 9, 4, 2008.
MILLER, F.G., et S.D. PEARSON.Coverage with evidence development: ethical issues and policy implications, « Medical Care », 46(7), 746-751, 2008.
MONANE, M., et J. AVORN. Medications and falls. Causation, correlation, and prevention. « Clinics in Geriatric Medicine », 12(4), 847-858, 1996.
NATIONAL INFORMATION GOVERNANCE BOARD. The Care Record Guarantee. Our guarantee for NHS care records in England, 2007. À l'adresse : http://www.nigb.nhs.uk/guarantee.
NATIONAL INSTITUTES OF HEALTH. National Institutes of Health Public Access Policy, 2008. À l'adresse : http://publicaccess.nih.gov/.
NATIONAL RESEARCH COUNCIL. For the Record. Protecting electronic health information, Washington, National Academy Press, 1997.
O'NEILL, O. Informed consent and genetic information, « Stud.Hist.Phil.Biol.& Biomed.Sci. », 32(4), 689-704, 2001.
OZIMEK, J. French storm the bastille over ‘Sarkozy's Big Sister' database, 2008. À l'adresse : http://www.theregister.co.uk/2008/09/11/france_database_tumulte/.
PEARSON, S.D., F.G. MILLER et E.J. EMANUEL. Medicare's requirement for research participation as a condition of coverage: is it ethical? « JAMA », 296(8), 988-991, 2006.
RAM, N. Tiered Consent and the Tyranny of Choice, « Jurimetrics », 48(3), 2008. À l'adresse : http://ssrn.com/abstract=1112364.
ROBLING, M.R., K. HOOD, H. HOUSTON, R. PILL, J. FAY et H.M. EVANS. Public attitudes towards the use of primary care patient record data in medical research without consent: a qualitative study, « J.Med.Ethics », 30(1), 104-109, 2004.
RORHSTEIN, M.A., et M.K. TALBOTT. Compelled Disclosure of Health Information: Protecting Against the Greatest Potential Threat to Privacy, « JAMA: The Journal of the American Medical Association », 295(24), 2882-2885, 2006.
SANDERS, D., et D. PROTTI. Data Warehouses in Healthcare: Fundamental Principles, « Electronic Healthcare », 6(3), 1-16, 2008. À l'adresse : http://www.longwoods.com/product.php?productid=19510&cat=524&page=1.
SHAFFER, C. Next-generation sequencing outpaces expectations, « Nature Biotechnology », 25(2), 149, 2007.
SINGLETON, P., et M. WADSWORTH. Consent for the use of personal medical data in research, « BMJ », 333(7561), 255-258, 2006.
SLAUGHTER, P.M., P.K. COLLINS, N. ROOS, K.M. WEISBAUM, M. HIRTLE, J. WILLIAMS, P.J. MARTENS et A. LAUPACIS. Harmonizing research & privacy: Standards for a collaborative future. Privacy best practices for secondary data use (SDU). [CD-ROM], Institute for Clinical Evaluative Sciences and Manitoba Centre for Health Policy, 2006.
SOUS‑GROUPE DU GER SUR LES QUESTIONS RELATIVES AUX PROCÉDURES DE L'EPTC (GROUPE PRO). Modifications proposées au texte de l'Énoncé de politique des trois Conseils : Éthique de la recherche avec des êtres humains (EPTC) sur les questions opérationnelles touchant aux CÉR, Ottawa, Groupe consultatif interagences en éthique de la recherche, 2008. À l'adresse : http://www.pre.ethics.gc.ca/francais/workgroups/progroup/REB_Operational_Issues.cfm.
TEZETA, F.M.a.K. ICES Report: Using Data from Electronic Medical Records: Theory versus Practice, « Healthcare Quarterly », 11(4), 23-25, 2008.
THURSBY, J.G., et M.C. THURSBY. Intellectual property. University licensing and the Bayh-Dole Act, « Science », 301(5636), 1052, 2003.
WALKER, A.M. More lawyers. More bureaucrats. Less information on drug safety, « Pharmacoepidemiology & Drug Safety », 15(6), 394-395, 2006.
WESTFALL, J.M., J. MOLD et L. FAGNAN. Practice-based research--"Blue Highways" on the NIH roadmap, « JAMA », 297(4), 403-406, 2007.
WILLISON, D.J., C. EMERSON, K.V. SZALA‑MENEOK, E. GIBSON, L. SCHWARTZ, K. WEISBAUM, F. FOURINER, K. BRAZIL et M.D. COUGHLIN. Access to medical records for research purposes: Varying perceptions across Research Ethics Boards, « J Med Ethics », 34 308-314, 2008a.
WILLISON, D.J., L. SCHWARTZ, J. ABELSON, C. CHARLES, M. SWINTON, D. NORTHRUP et L. THABANE. Alternatives to project-specific consent for access to personal information for health research: What is the opinion of the Canadian public? « Journal of the American Medical Informatics Association », 14 706-712, 2007.
WILLISON, D.J., M. SWINTON, L. SCHWARTZ, J. ABELSON, C. CHARLES, D. NORTHRUP, J. CHENG et L. THABANE. Alternatives to project-specific consent for access to personal information for health research: insights from a public dialogue, « BMC Med.Ethics », 9(18), doi:10.1186/1472-6939-9-18, 2008b.
WILLISON, D.J., M.K. KAPRAL, P. PELADEAU, J.A. RICHARDS, J. FANG et F.L. SILVER. Variation in recruitment across sites in a consent-based clinical data registry: lessons from the Canadian Stroke Network. « BMC Medical Ethics », 7(6), doi:10.1186/1472-6939-7-6, 2006.
WINICKOFF, D.E. Governing stem cell research in California and the USA: towards a social infrastructure, « Trends in Biotechnology », 24(9), 390-394, 2006.
WINICKOFF, D.E., et R.N. WINICKOFF. The charitable trust as a model for genomic biobanks, « New England Journal of Medicine », 349(12), 1180-1184, 2003.
WOLF, L.E., J. ZANDECKI et B. LO. The certificate of confidentiality application: a view from the NIH Institutes, « Irb: a Review of Human Subjects Research », 26(1), 14-18, 2004.
WOLF, S.M., F.P. LAWRENZ, C.A. NELSON, J.P. KAHN, M.K. CHO, E.W. CLAYTON, J.G. FLETCHER, M.K. GEORGIEFF, D. HAMMERSCHMIDT, K. HUDSON, J. ILLES, V. KAPUR, M.A. KEANE, B.A. KOENIG, B.S. LEROY, EG. MCFARLAND, J. PARADISE, L.S. PARKER, S.F. TERRY, N.B. VAN et B.S. WILFOND. Managing incidental findings in human subjects research: analysis and recommendations, « Journal of Law, Medicine & Ethics », 36(2), 219-248, 2008.
YEATES, N., D.K. LEE et M. MAHER. Health Canada's Progressive Licensing Framework, « JAMC Journal de l'Association médicale canadienne », 176(13), 1845-1847, 2007.
Supports de substitution
- PDF (213 Ko) Accessibilité non vérifiée
- Date de modification :

